Brian S Hooker1, Neil Z Miller2
1Department of Sciences and Mathematics, Simpson University, Redding, CA, USA
2Institute of Medical and Scientific Inquiry, Santa Fe, NM, USA
Corresponding Author:
Brian S Hooker, Department of Sciences and Mathematics, Simpson University, 2211 College View Drive, Redding, CA 96003, USA.
Email: drbrianhooker@gmail.com
Pubblicato per la prima volta il 27 maggio 2020
https://doi.org/10.1177/2050312120925344
Obiettivo:
Lo scopo di questo studio era di confrontare la salute delle popolazioni pediatriche vaccinate con quella delle popolazioni pediatriche non vaccinate.
Metodi:
Utilizzando i dati di tre studi medici negli Stati Uniti con bambini nati tra novembre 2005 e giugno 2015, i bambini vaccinati sono stati confrontati con i bambini non vaccinati durante il primo anno di vita per la successiva incidenza di ritardi dello sviluppo, asma, infezioni dell’orecchio e disturbi gastrointestinali. Tutte le diagnosi hanno utilizzato la Classificazione Internazionale delle Malattie-9 e la Classificazione Internazionale delle Malattie-10 attraverso la revisione della cartella clinica. I soggetti erano un minimo di 3 anni di età, stratificati in base alla pratica medica, all’anno di nascita e al sesso e confrontati utilizzando un modello di regressione logistica.
Risultati:
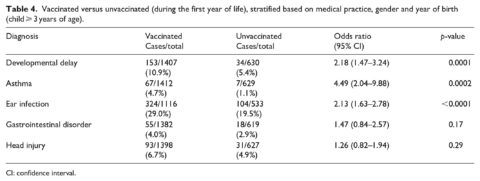
La vaccinazione prima di 1 anno di età è stata associata ad un aumento delle probabilità di ritardi nello sviluppo (OR = 2,18, 95% IC 1,47-3,24), asma (OR = 4,49, 95% CI 2,04-9,88) e infezioni dell’orecchio (OR = 2,13, 95% CI 1,63-2,78). In un’analisi quartile, i soggetti sono stati raggruppati per numero di dosi di vaccino ricevute nel primo anno di vita. Sono stati osservati rapporti di probabilità più elevati nei quartili 3 e 4 (dove sono state ricevute più dosi di vaccino) per tutte e quattro le condizioni di salute considerate, rispetto al quartile 1. In un’analisi temporale, i ritardi nello sviluppo hanno mostrato un aumento lineare in quanto i limiti di età sono passati da 6 a 12 a 18 a 24 mesi (OR = 1,95, 2,18, 2,92 e 3,51, rispettivamente). Sono stati osservati OR leggermente più alti anche per tutte e quattro le condizioni di salute quando il tempo consentito per una diagnosi è stato esteso da ⩾ 3 anni di età a ⩾ 5 anni.
Conclusione:
In questo studio, che ha permesso solo il calcolo delle associazioni osservazionali non corrette, sono state osservate OR più elevate all’interno del gruppo vaccinato rispetto a quello non vaccinato per ritardi dello sviluppo, asma e infezioni dell’orecchio. Un ulteriore studio è necessario per comprendere l’intero spettro degli effetti sulla salute associati alla vaccinazione infantile.
Introduzione
La vaccinazione è considerata uno dei progressi più importanti nella salute pubblica moderna.1 Attualmente, i bambini tra la nascita e i 6 anni di età ricevono fino a 36 dosi di vaccino per proteggere da 14 diverse malattie, secondo il programma raccomandato dal Centro per il controllo e la prevenzione delle malattie (CDC).2 Per l’età di 1 e 2 anni, il CDC raccomanda circa 21 e 28 dosi di vaccinazione, rispettivamente. Il numero di dosi di vaccino ricevute dai neonati e dai bambini è aumentato soprattutto dai primi anni ’90, quando sono stati introdotti i vaccini contro l’epatite B e l’Haemophilus influenzae di tipo B. Attualmente, i bambini negli Stati Uniti sono vaccinati per l’epatite A e B, Haemophilus influenzae di tipo B, difterite, pertosse, tetano, polio, morbillo, parotite, rosolia, rotavirus, polmonite da pneumococco, influenza e varicella.
Sebbene i test clinici a breve termine siano stati completati su singoli vaccini (con un limitato follow-up a lungo termine per specifici eventi avversi del vaccino) prima dell’approvazione da parte della US Food and Drug Administration (FDA), i risultati sanitari relativi a questi vaccini e il programma di vaccinazione nel suo complesso sono in gran parte sconosciuti.3 Ad esempio, Kuter et al.4 hanno dettagliato 23 diversi studi post-licenziamento condotti sul vaccino contro il morbillo, la parotite e la rosolia (MMR)-II e in nessun caso i pazienti sono stati seguiti per più di 42 giorni dopo la vaccinazione. Nel 2011 l’Istituto di Medicina (OIM)5 ha pubblicato il rapporto “Effetti avversi dei vaccini”: Evidenza e causalità” dove sono state considerate le relazioni tra vaccini specifici e diversi effetti avversi sulla salute. Sulla base dell’attuale letteratura scientifica, il comitato dell’OIM ha trovato prove inadeguate per accettare o respingere una relazione causale tra 135 dei 158 rapporti tra vaccini ed eventi avversi. Tra i rimanenti 23 eventi avversi, 18 sono stati trovati associati alla vaccinazione e 5 no.
La comunità medica riconosce in generale che la vaccinazione non è priva di rischi per la salute, compresa la morte.6 Tuttavia, è opinione diffusa che questi effetti collaterali o “eventi avversi” siano estremamente rari e giustificati rispetto al beneficio complessivo della vaccinazione.7 Sono stati riportati pochissimi studi in cui sono stati valutati gli effetti sulla salute del programma di vaccinazione infantile e infantile degli Stati Uniti. Ciò si basa in parte sulle preoccupazioni etiche di rifiutare la vaccinazione a un gruppo di controllo non vaccinato all’interno di un tale studio.8 Infatti, ciò preclude l’uso di studi in doppio cieco con placebo sugli effetti sulla salute del vaccino, e anche negli studi clinici viene spesso utilizzata una versione precedente dello stesso vaccino come controllo placebo per il vaccino appena testato.
Uno studio, pubblicato da Mawson et al.,3 si basava su un campione di convenienza di bambini che studiavano a casa, dove una parte significativa del campione (39%) non era stata vaccinata. In questo piccolo campione, i bambini vaccinati hanno mostrato maggiori probabilità di essere diagnosticati con polmonite, otite media, allergie e disturbi dello sviluppo neurologico. Inoltre, la nascita pretermine abbinata alla vaccinazione ha aumentato significativamente le probabilità di una diagnosi di disturbo dello sviluppo neurologico. Questo studio è stato unico nell’inclusione di popolazioni interamente non vaccinate per fornire un confronto con bambini parzialmente vaccinati e completamente vaccinati. Tuttavia, il rischio di distorsioni è elevato quando si confrontano i bambini vaccinati con quelli non vaccinati. Inoltre, i risultati sanitari si sono basati su un’indagine tra i genitori, non confermata dalla revisione della cartella clinica, e possono essere soggetti a pregiudizi di richiamo, e le piccole dimensioni del campione (666 pazienti) hanno reso difficile l’analisi per i disturbi rari.
Tra il 2001 e il 2004, l’IOM9 Immunization Safety Review Committee ha respinto una relazione tra le vaccinazioni multiple e la sindrome della morte improvvisa del lattante (SIDS), ma non ha potuto escludere una relazione con altri tipi di “morte improvvisa e inaspettata del lattante”. Questo includeva il vaccino neonatale contro l’epatite B, nonché il vaccino contro la difterite e il tossoide tetanico e il vaccino contro la pertosse a cellule intere (DTwP), che era fortemente associato all’anafilassi, ma che non viene più somministrato negli Stati Uniti. Una relazione tra vaccini multipli e diabete di tipo 1 è stata esclusa, ma le prove erano inadeguate per accettare o rifiutare una relazione con l’asma.10 Inoltre, il comitato ha respinto una relazione tra vaccini multipli e un aumento delle infezioni “eterologhe”, come infezioni batteriche non correlate a malattie a prevenzione vaccinale, anche se studi recenti hanno fornito prove di effetti sia benefici che dannosi non specifici associati a diversi vaccini.11-13 Il resto del Comitato di revisione della sicurezza dell’immunizzazione dell’OIM si è concentrato su singoli tipi di vaccini ed eventi avversi specifici, come raccomandato dal CDC che ha commissionato questi studi.
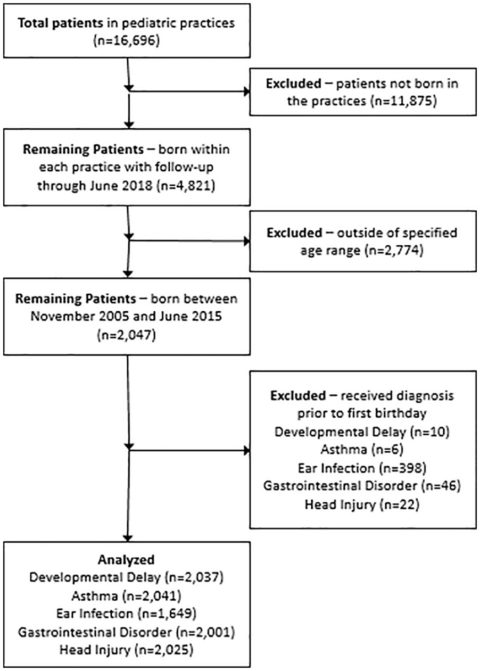
Nello studio qui presentato, i bambini di tre diversi studi medici pediatrici negli Stati Uniti sono stati utilizzati come campione di convenienza per confrontare i pazienti vaccinati e non vaccinati entro il primo anno di vita. Le registrazioni delle vaccinazioni erano basate su dati contenuti nel sistema di cartelle cliniche elettroniche (EMR) di ogni studio. Sono state valutate quattro diverse diagnosi, insieme a una diagnosi di controllo che si presumeva non fosse correlata con lo stato di vaccinazione. Per consentire il tempo necessario per effettuare una diagnosi, i bambini avevano un minimo di 3 anni per ogni analisi completata (ad eccezione della tabella 9, dove l’età minima è stata estesa).
Materiali e metodi
Fonte dei dati
I dati dei pazienti sono stati ottenuti dai sistemi EMR di tre studi pediatrici negli Stati Uniti. Tutti i dati utilizzati direttamente per lo studio sono stati dapprima de-identificati in modo che l’identificazione specifica del paziente non potesse essere effettuata dai file di origine utilizzati nella programmazione statistica. L’Institutional Review Board della Simpson University per la ricerca su soggetti umani ha esaminato e autorizzato questa analisi indipendentemente dai ricercatori.
I pazienti dello studio avevano un minimo di 3 anni di età e sono stati costantemente iscritti alla loro pratica medica dalla nascita al giugno 2018. Tutti i pazienti sono nati dopo il novembre 2005. Il processo di selezione della coorte è mostrato nella Figura 1. La data di vaccinazione, l’età al momento della vaccinazione e il tipo (quando disponibile) sono stati ottenuti dagli EMR della pratica e tabulati in un file di dati separato e non identificato. Tutte le diagnosi prese in considerazione si sono basate su codici appropriati di classificazione internazionale delle malattie (ICD)-9 e ICD-10. Le diagnosi considerate includevano ritardi nello sviluppo, asma, infezioni dell’orecchio e disturbi gastrointestinali. Il trauma cranico è stato incluso come risultato di controllo negativo, o diagnosi di controllo, presumibilmente non associato allo stato di vaccinazione. Altre diagnosi, tra cui autismo e ADD/ADHD, sono state prese in considerazione per la valutazione. Tuttavia, non esisteva un numero sufficiente di casi tra le pratiche per completare una rigorosa analisi statistica.
I codici di diagnosi (ICD-9 e ICD-10) utilizzati per ogni condizione sono riportati nella Tabella 1. I codici troncati, ad esempio, il codice ICD-9 codice 315 (ritardi specifici di sviluppo) come categoria generale per i ritardi di sviluppo, includono tutti i codici di tale classificazione. Un codice ICD-9 di 315.9 (ritardo di sviluppo non specificato) verrebbe pertanto conteggiato come caso nella categoria “ritardo di sviluppo”. Inoltre, in alcuni casi, come ad esempio i “disturbi gastrointestinali”, per determinare i casi è stata utilizzata una serie di codici ICD-9 e ICD-10. In particolare, per i disturbi gastrointestinali, sono state prese in considerazione solo le enteriti e le coliti non infettive.
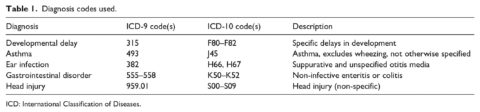
Poiché le infezioni all’orecchio possono verificarsi più di una volta nello stesso bambino, i casi sono stati identificati come bambini che hanno ricevuto il codice di diagnosi in almeno una visita medica. Così, ad esempio, i bambini che hanno avuto un’infezione all’orecchio o più infezioni all’orecchio sono stati conteggiati come casi e i bambini che non hanno riportato alcuna infezione all’orecchio sono stati conteggiati come non casi.
pazienti nella categoria “vaccinati” hanno ricevuto un minimo di una dose di vaccino prima del loro primo compleanno più 15 giorni per catturare i vaccini di 1 anno come raccomandato nel programma CDC, mentre i pazienti “non vaccinati” non avevano dosi di vaccino su record prima del loro primo compleanno più 15 giorni. Il numero di dosi di vaccino ricevute prima di 1 anno di età è stato calcolato come il numero di volte che un codice ICD-9 o ICD-10 per la vaccinazione è stato registrato nell’EMR del paziente. Questo limite di età è stato utilizzato perché la maggior parte dei vaccini somministrati in base al programma di vaccinazione infantile e infantile del CDC statunitense viene somministrato prima di 1 anno di età (21 dosi di vaccino dalla nascita a 1 anno di età contro 33 dosi di vaccino da 1 a 18 anni di età). Ciò rappresenta anche le dosi di vaccino multiple somministrate in un’unica visita al fornitore del servizio medico. ( Tetano-difterite pertosse acellulare (TdaP) e MMR, tra le altre vaccinazioni combinate, sono state conteggiate come un unico vaccino, anche se consistono di tre vaccini in una singola iniezione). A causa delle differenze nelle pratiche di registrazione tra i pediatri partecipanti, in questo studio non è stato fatto alcun tentativo di differenziare tra i tipi di vaccini somministrati a questi neonati. Inoltre, a causa dell’indisponibilità del tipo di vaccino somministrato in ogni visita in uno degli studi medici, non sono state prese in considerazione le relazioni temporali tra i vaccini specifici e le diagnosi.
Metodo di analisi
Questo studio ha impiegato un disegno di studio di coorte con strati per la pratica medica, anno di nascita e sesso. I casi sono stati valutati rispetto ai non casi per un’associazione tra lo stato di vaccinazione e le diverse condizioni di salute considerate utilizzando un modello di regressione logistica condizionale. La SAS® University Edition è stata utilizzata per analisi statistiche con relazioni ritenute significative a p < 0,05 senza correzione per il numero di test statistici eseguiti. In generale, con un campione di circa 2000 soggetti, lo studio è stato progettato per avere una potenza dell’80% per rilevare odds ratio di 1,8 (α = 0,05 e un livello di confidenza di 0,95), ma a causa di alcune diagnosi più rare, l’80% di potenza in casi selezionati è stato sufficiente solo per rilevare odds ratio di 2,4 e superiori. In questo modello non sono state prese in considerazione le covariate a causa della mancanza di disponibilità di dati materno-infettivi rilevanti.
Nell’analisi primaria (tabella 4), i risultati per i “bambini vaccinati” sono stati confrontati direttamente con quelli per i “bambini non vaccinati”. I bambini che non hanno ricevuto alcun vaccino durante il primo anno di vita (più 15 giorni) sono stati considerati “non vaccinati” indipendentemente dai vaccini che avrebbero potuto essere ricevuti dopo il loro primo compleanno. Il gruppo dei non vaccinati era composto dall’83,7% dei bambini non vaccinati all’interno del loro intero EMR e dal 16,3% dei bambini che hanno ricevuto il primo vaccino dopo 1 anno di vita, in base alla coorte di 3 anni e oltre. Questa analisi è stata completata su tutti i bambini, così come su maschi e femmine separatamente (Tabelle 5 e 6). Le diagnosi sono state prese in considerazione sia per i soggetti vaccinati che per quelli non vaccinati solo quando si sono verificati dopo il primo compleanno (più 15 giorni). I bambini che hanno ricevuto le diagnosi prima del loro primo compleanno (più 15 giorni) sono stati esclusi da ogni analisi specifica.
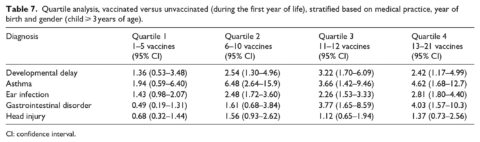
Nella seconda analisi (Tabella 7), i soggetti sono stati separati in quartili in base al numero di dosi di vaccino ricevute entro il primo anno di vita (più 15 giorni) calcolato in base alla distribuzione tra il campione con una mediana di nove dosi di vaccino. Il primo quartile comprendeva bambini che hanno ricevuto 1-5 dosi di vaccino (n = 353), il secondo comprendeva bambini che hanno ricevuto 6-10 dosi di vaccino (n = 390), il terzo comprendeva bambini che hanno ricevuto 11-12 dosi di vaccino (n = 417) e il quarto comprendeva bambini che hanno ricevuto 13-21 dosi di vaccino (n = 254). Le diagnosi per le condizioni all’interno di questa analisi sono state prese in considerazione solo se sono state fatte dopo il primo compleanno di ogni bambino (più 15 giorni). Questa analisi è stata limitata alle dosi di vaccino ricevute nel primo anno di vita per catturare una parte significativa delle diagnosi che possono verificarsi nei primi anni di vita, comprese le infezioni dell’orecchio e i disturbi gastrointestinali.
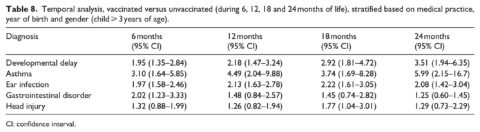
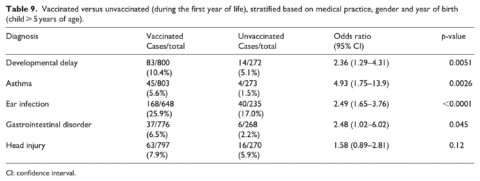
Nella terza analisi (tabella 8), lo stato di vaccinazione è stato considerato a intervalli di età separati dalla nascita fino a 6 mesi, 1 anno, 18 mesi e 2 anni in quattro analisi separate. Le diagnosi sono state considerate solo dopo l’intervallo di età della vaccinazione. È stata inoltre completata una quarta analisi (tabella 9), identica alla prima analisi (considerando lo stato di vaccinazione fino al primo anno di età). Tuttavia, il limite di età per la coorte era di 5 anni e oltre, anziché di 3 anni e oltre, per dare ai bambini un tempo supplementare per la diagnosi delle condizioni considerate.
Risultati
Dati demografici
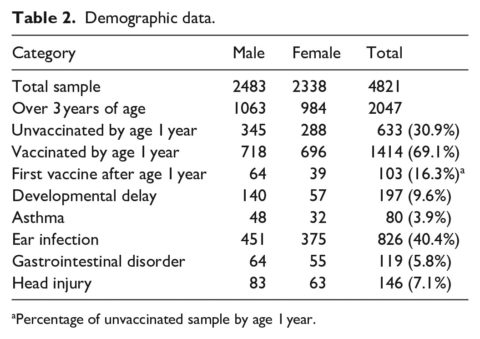
I dati demografici del campione di studio sono riportati nella tabella 2. La dimensione complessiva del campione, inclusi i bambini di età inferiore ai 3 anni, è di 4821, di cui il 44,5% non è stato vaccinato, mentre il 55,5% è stato vaccinato. Tra i 3797 bambini di età superiore a 1 anno, il 37,6% non è stato vaccinato e il 62,4% è stato vaccinato. Considerando i bambini con follow-up continuo che avevano più di 3 anni di età, il campione si è ridotto a 2047 pazienti, con il 52% di maschi. I bambini non vaccinati a 1 anno di età hanno costituito il 30,9% del campione rispetto ai bambini vaccinati (69,1%). La diagnosi più diffusa è stata l’infezione dell’orecchio.
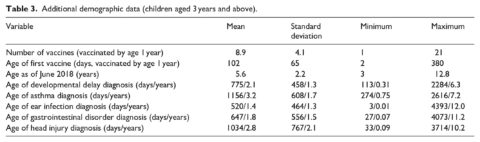
Ulteriori dati demografici nella Tabella 3 includono il numero di vaccini somministrati prima del primo compleanno di ogni bambino (range = 1-21), l’età della prima vaccinazione in giorni (media = 102, o 3,3 mesi) e l’età dei bambini al termine del periodo di studio (media = 5,6 anni). Infine, sono incluse le età della prima diagnosi per ciascuna delle condizioni considerate nelle analisi. Mentre le diagnosi, come i ritardi dello sviluppo, l’asma e i traumi cranici, si sono verificati in genere dopo l’età limite di 1 anno per le analisi, un numero significativo di infezioni dell’orecchio (48,2%) e di disturbi gastrointestinali (38,7%) è stato diagnosticato prima del primo compleanno.
Analisi statistica
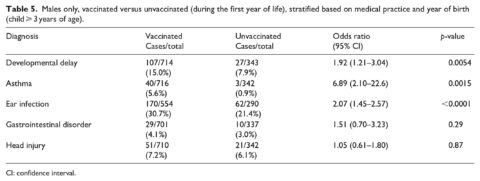
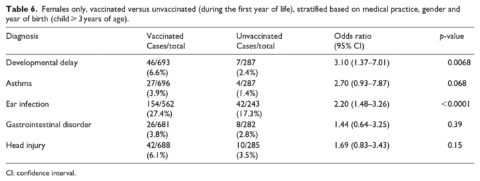
La tabella 4 mostra i risultati quando i casi sono stati confrontati con i non casi nelle categorie vaccinati e non vaccinati (a partire dai 3 anni di età con diagnosi considerate solo dopo il primo compleanno). La vaccinazione prima di 1 anno di età è stata associata ad un aumento delle probabilità di ritardi nello sviluppo (odds ratio, OR = 2,18, 95% IC 1,47-3,24), asma (OR = 4,49, 95% CI 2,04-9,88) e infezioni dell’orecchio (OR = 2,13, 95% CI 1,63-2,78). Non è stata osservata alcuna relazione per disturbi gastrointestinali e traumi cranici (la diagnosi di controllo). Risultati simili sono stati osservati solo per i maschi (Tabella 5) con un forte aumento della OR per l’asma (6,89, 95% CI 2,10-22,6, p = 0,0015). Solo nelle femmine (Tabella 6), è stato osservato un aumento dell’OR per ritardi nello sviluppo (OR = 3,10, 95% CI 1,37-7,01, p = 0,0068). Gli intervalli di fiducia per questa relazione sono coerenti con i risultati complessivi e “solo per i maschi”. Anche per le sole femmine, il risultato per l’asma è sceso al di sotto del livello di significatività (p = 0,068). Il resto delle condizioni studiate ha mostrato risposte coerenti con i risultati precedenti per i maschi e per l’intero campione.
I risultati dell’analisi del quartile, che valuta il numero di dosi di vaccino ricevute nel primo anno di vita rispetto ai bambini non vaccinati, sono riportati nella tabella 7. Sono stati osservati OR più elevati nei quartili 3 e 4 (dove sono state ricevute più dosi di vaccino) per tutte e quattro le condizioni di salute considerate, rispetto al quartile 1. Un aumento lineare coerente degli OR con dosi crescenti di vaccino è stato osservato per i disturbi gastrointestinali, anche se la relazione è significativa solo nel terzo e quarto quartile (OR = 3,77, 95% CI 1,65-8,59 e OR = 4,03, 95% CI 1,57-10,3, rispettivamente). Le relazioni per l’asma e il ritardo di sviluppo non sono significative solo per il primo quartile, ma gli OR raggiungono un picco all’interno del secondo quartile per l’asma e all’interno del terzo quartile per il ritardo di sviluppo, seguito da un declino – anche se ancora molto significativo – nei quartili successivi. La diagnosi di controllo non mostra una relazione in nessuno dei quartili.
Nell’ambito dell’analisi temporale (risultati riportati nella tabella 8), i vaccini sono stati considerati alle età limite (6, 12, 18 e 24 mesi) e le diagnosi sono state incluse solo dopo tali età limite. Così, il cut-off di 6 mesi aiuterebbe a tener conto delle diagnosi precoci, specialmente delle infezioni dell’orecchio e dei disturbi gastrointestinali che sono stati diagnosticati spesso entro il primo anno di vita. Il gruppo non vaccinato era composto da bambini che ricevevano i primi vaccini solo dopo ogni limite di età. Un consistente aumento lineare degli OR è stato osservato per i ritardi nello sviluppo, poiché i limiti di età sono passati da 6 a 12 a 18 a 24 mesi (OR = 1,95, 2,18, 2,92 e 3,51, rispettivamente). Tutti i risultati per i ritardi nello sviluppo sono stati statisticamente significativi, così come tutti i risultati per l’asma e le infezioni dell’orecchio. L’asma, che era associata all’età media di diagnosi più alta di tutte le condizioni studiate, ha mostrato il più alto OR al cut-off di 24 mesi (OR = 5,99, 95% CI 2,15-16,7), simile al risultato per i ritardi dello sviluppo. Tuttavia, l’aumento osservato tra il cut-off di 6 mesi e quello di 24 mesi non è stato coerente. Gli OR per le infezioni dell’orecchio erano quasi costanti a tutti i cut-off di età, mentre il rapporto per i disturbi gastrointestinali era più alto e significativo solo al cut-off di 6 mesi (OR = 2,02, 95% IC 1,23-3,33). Un’unica relazione significativa è stata osservata per la diagnosi di controllo del trauma cranico al cut-off di 18 mesi di vaccinazione.
Un’analisi finale è stata completata in modo simile all’analisi presentata nella Tabella 4, ma con bambini del campione che avevano 5 anni e più prima della data limite di giugno 2018. I risultati per questo gruppo (Tabella 9) sono coerenti con quelli osservati in precedenza. Quando il tempo consentito per una diagnosi è stato esteso dai bambini ⩾ di 3 anni ai bambini ⩾ di 5 anni, sono stati rilevati OR leggermente più alti per tutte e quattro le condizioni di salute: ritardi nello sviluppo (OR = 2,36, 95% CI 1,29-4,31), asma (OR = 4,93, 95% CI 1,75-13,9), infezioni dell’orecchio (OR = 2,49, 95% CI 1,65-3,76) e disturbi gastrointestinali (OR = 2,48, 95% CI 1,02-6,02).
Discussione
All’interno di questo studio, il numero di vaccini ricevuti e lo stato di vaccinazione all’inizio della vita sono correlati a diverse condizioni acute e croniche. Le relazioni più forti osservate per lo stato di vaccinazione sono state per l’asma, i ritardi nello sviluppo e le infezioni dell’orecchio (Tabella 4). Sebbene l’associazione tra vaccinazioni e asma nei maschi sia stata elevata (Tabella 5), va notato che ci sono stati solo tre casi di asma nel gruppo non vaccinato. Non è stata riscontrata alcuna associazione tra vaccinazioni e asma nelle femmine (Tabella 6); ciò può anche essere dovuto a soli quattro casi di asma nel gruppo non vaccinato. Sebbene alcuni studi non siano stati in grado di trovare correlazioni tra vaccini e asma,14-15 è stata riportata una relazione tra vaccinazione e incidenza di allergia/atopia (asma inclusa).16-18 In uno studio che coinvolgeva bambini coreani vaccinati contro l’epatite B, è stata riscontrata un’incidenza di asma significativamente più alta tra i bambini che si erano effettivamente sieroconvertiti per produrre anti-HepB.16 Inoltre, Hurwitz e Morgenstern17 hanno riportato un’associazione tra la vaccinazione contro la difterite-tetano-pertosse (DTP) e la vaccinazione contro il tossoide tetanico e i sintomi dell’allergia e non hanno potuto escludere una relazione con l’asma. In uno studio su animali, i topi vaccinati secondo il programma del vaccino infantile cinese hanno mostrato un’iperreattività delle vie aeree ad un tasso significativamente più alto rispetto ai topi non vaccinati.18
L’IOM19 Immunization Safety Review Committee ha condotto una valutazione riguardante i vaccini contenenti il timerosal e ha concluso che “l’ipotesi che l’esposizione ai vaccini contenenti il timerosal possa essere associata a disturbi dello sviluppo neurologico” è biologicamente plausibile. Mawson et al.3 hanno trovato una relazione tra lo stato di vaccinazione e la disabilità di apprendimento e i disturbi dello sviluppo neurologico. Delong20 hanno anche riportato una relazione significativa con i disturbi dello sviluppo neurologico (autismo e ritardo nel linguaggio e nel linguaggio) se si considerano le proporzioni dell’assorbimento del vaccino nei bambini americani. Altre ricerche, focalizzate maggiormente sull’assorbimento di vaccini specifici, hanno chiarito tali relazioni. Gallagher e Goodman21 hanno visto un numero maggiore di ragazzi ricevere servizi educativi speciali se avessero ricevuto l’intera serie di vaccini contro l’epatite B durante l’infanzia. Geier et al.22-24 hanno anche documentato un collegamento tra i disturbi dello sviluppo neurologico e i vaccini contenenti il talismano. (Sebbene il thimerosal sia stato gradualmente eliminato dalla maggior parte dei vaccini somministrati negli Stati Uniti, rimane ancora in alcune formulazioni del vaccino antinfluenzale somministrato a donne in gravidanza e neonati).
Mawson et al.3 hanno riportato una relazione significativa tra lo stato di vaccinazione e le infezioni dell’orecchio. Wilson et al.25 hanno scoperto che, sia per i maschi che per le femmine, i motivi principali per le visite al pronto soccorso e/o i ricoveri ospedalieri dopo le vaccinazioni di 12 mesi comprendevano infezioni dell’orecchio e gastroenterite o colite non infettiva. Prima che il vaccino RotaTeq rotavirus ottenesse l’approvazione della FDA, 71.725 neonati sono stati valutati in tre studi clinici controllati con placebo. L’otite media (infezione dell’orecchio medio) si è verificata con un’incidenza statisticamente più elevata (p < 0,05) entro 6 settimane da qualsiasi dose tra i destinatari del RotaTeq rispetto ai destinatari del placebo.26
All’interno dell’analisi del quartile (Tabella 7), l’asma non era significativa nel primo quartile, ha raggiunto il picco nel secondo quartile (OR = 6,48, 95% CI 2,64-15,9), poi è diminuita nel terzo e quarto quartile, ma ha mantenuto la sua importanza (OR = 3,66, 95% CI 1,42-9,46 e OR = 4,62, 95% CI 1,68-12,7, rispettivamente). I ritardi nello sviluppo hanno seguito uno schema simile, anche se il picco si è verificato nel terzo quartile. Questo può indicare la presenza di “pregiudizio dell’utente sano” all’interno del campione complessivo in cui i soggetti sani continuano a vaccinare ma i soggetti con problemi di salute limitano o limitano ulteriori vaccinazioni, come definito in precedenza da Fine e Chen.27 Questi autori hanno discusso il fenomeno in cui l’elusione o il ritardo della vaccinazione è associato ad un aumento del rischio di eventi avversi del vaccino. In altre parole, i bambini vaccinati più sani hanno maggiori probabilità di rimanere “aggiornati” con le vaccinazioni, mentre i bambini che mostrano problemi di salute possono optare per un programma ritardato o per saltare i vaccini specifici. Nel contesto del loro articolo, Fine e Chen hanno sottolineato che questo può confondere le analisi dei rischi associati ai bambini vaccinati rispetto a quelli non vaccinati, portando ad un sotto-rischio. Tuttavia, nell’analisi presentata in questo articolo, il numero di dosi di vaccino è stato confrontato (attraverso quartili) direttamente con i bambini completamente non vaccinati per minimizzare tale polarizzazione. In contrasto con l’asma e i ritardi nello sviluppo, nei quartili 3 e 4 sono stati osservati OR più elevati per tutte e quattro le condizioni di salute considerate, rispetto al quartile 1, che può indicare un effetto cumulativo delle dosi di vaccino.
L’analisi temporale (Tabella 8) ha permesso di differenziare l’età limite di vaccinazione e la diagnosi. Ad esempio, a 6 mesi, sono state contate solo le dosi di vaccino tra la nascita e i 6 mesi e le diagnosi sono state considerate solo dopo i 6 mesi di età. Il cut-off precedente di 6 mesi ha permesso di contabilizzare più diagnosi di infezioni dell’orecchio e disturbi gastrointestinali che hanno un’età media di diagnosi più precoce. Tuttavia, questo ha portato a un compromesso in base al quale erano disponibili meno bambini vaccinati da valutare. Al contrario, a 24 mesi, è stato contabilizzato un numero maggiore di bambini vaccinati, ma a scapito delle diagnosi precedenti a tale limite di età. È interessante notare che i ritardi nello sviluppo, che avevano un’età media di diagnosi più alta, hanno mostrato un aumento lineare delle sale operatorie con l’aumento dell’età limite. Anche l’asma, che aveva l’età media di diagnosi più alta di tutte le condizioni studiate, ha mostrato il più alto valore di OR al cut-off di 24 mesi. Tuttavia, l’aumento osservato tra i cut-off di 6 e 24 mesi non è stato coerente e può riflettere il basso numero di casi di asma nel campione complessivo. L’OR per i disturbi gastrointestinali era più alto e significativo solo al cut-off di 6 mesi, il che può suggerire un collegamento con le vaccinazioni precedenti nei bambini. Una singola relazione significativa è stata osservata per la diagnosi di controllo del trauma cranico al cut-off di 18 mesi di vaccinazione, il che può essere indicativo di differenze nel comportamento di ricerca di assistenza sanitaria tra le famiglie di bambini vaccinati e non vaccinati. Questo potrebbe anche essere un artefatto del piccolo numero di lesioni nel gruppo di analisi che potrebbe introdurre una granularità all’interno delle analisi che coinvolgono sottogruppi di soggetti vaccinati (Tabelle 7 e 8). Questo limita la nostra capacità di vedere potenziali confusioni e pregiudizi all’interno di questo studio.
In ultima analisi (Tabella 9), sono state rilevate OR superiori per tutte e quattro le condizioni di salute quando il tempo consentito per una diagnosi è stato esteso dai bambini ⩾ di 3 anni ai bambini ⩾ di 5 anni. Questo requisito di età più elevato ha permesso di concedere ai bambini un tempo supplementare per ricevere le diagnosi, il che è importante soprattutto per i ritardi dello sviluppo e l’asma che vengono diagnosticati in seguito all’interno del campione (Tabella 3). Tuttavia, questo ha anche portato a un minor numero di bambini in generale, compresi solo quattro bambini con una diagnosi di asma nel gruppo non vaccinato.
La rilevanza statistica è stata osservata per i disturbi gastrointestinali se si considerano il terzo e il quarto quartile delle dosi di vaccino, all’età limite di 6 mesi nell’analisi temporale e quando è stato concesso un tempo supplementare per una diagnosi. Le analisi rimanenti non hanno mostrato una relazione. Sebbene Wilson et al.25 abbiano trovato un’associazione tra le vaccinazioni a 12 mesi e le visite al pronto soccorso per le gastroenterite non infettiva, c’è una scarsità di ricerche altrove per quanto riguarda la gastroenterite dopo la vaccinazione, con la maggioranza concentrata sull’intussuscezione dopo il vaccino contro il rotavirus.28-31 Altri rapporti hanno attribuito i disturbi gastrointestinali come eventi avversi dopo il vaccino antipolio orale32 e il vaccino contro il papillomavirus umano.33
Punti di forza dello studio
Uno dei principali punti di forza di questo studio è che i dati si basano direttamente sulle cartelle cliniche dei pazienti e sui codici di diagnosi. I medici che effettuano queste diagnosi erano anche direttamente disponibili per la consultazione su come sono stati applicati i codici di diagnosi specifici. Inoltre, le registrazioni delle vaccinazioni si sono basate sui dati della cartella clinica del paziente, anche se le pratiche di codifica per le vaccinazioni variavano tra le tre diverse pratiche pediatriche. Per tener conto di eventuali differenze nella diagnosi tra le tre diverse pratiche, i casi e i non casi sono stati stratificati in base alla pratica medica. Pertanto, non sono stati effettuati “confronti incrociati” tra due o più studi medici. Per tener conto delle differenze di probabilità di diagnosi particolari in base all’età e al sesso del paziente, i casi e i non casi sono stati stratificati in base all’anno di nascita e al sesso.
È possibile che le diagnosi siano state omesse o che le informazioni relative ai vaccini somministrati siano state registrate in modo errato, con conseguente errata classificazione dell’esposizione, il che potrebbe spiegare l’alto tasso di bambini non vaccinati nella coorte. Tuttavia, tutti i bambini considerati nello studio sono stati arruolati nella loro pratica medica dalla nascita e seguiti in modo continuativo fino alla soglia di età minima di 3 anni (tabelle 4-8) e 5 anni (tabella 9). Questo ha ridotto al minimo il rischio di mancare le dosi di vaccinazione o le diagnosi associate al monitoraggio dei pazienti con più medici. Questo ha anche eliminato i pregiudizi di richiamo associati agli studi focalizzati sulle indagini parentali. L’alta percentuale di bambini non vaccinati è molto probabilmente indicativa di pratiche pediatriche che accettavano bambini non vaccinati e parzialmente vaccinati nel loro carico di casi.
Inoltre, le date limite (ad es. 1 anno più 15 giorni) hanno stabilito chiari confini tra il momento in cui è stato possibile determinare lo stato di vaccinazione di un bambino e quello in cui le diagnosi sarebbero state prese in considerazione. Tutti i vaccini ricevuti dal bambino sono stati conteggiati prima del cut-off e le diagnosi sono state prese in considerazione solo dopo il cut-off. Ogni bambino che riceveva una diagnosi prima del limite di età è stato eliminato da quella parte dell’analisi. A questo proposito, questo studio si concentra più sui vaccini ricevuti prima nella vita che su quelli ricevuti dopo 1 e 2 anni di età. Per i cut-off di 1 e 2 anni, l’83,7% e il 91,1% degli individui erano per definizione “completamente non vaccinati”, rispettivamente (calcolati sulla base dell’intero campione non vaccinato per ogni cut-off), mentre il resto riceveva i primi vaccini dopo l’età cut-off. Ciò tenderebbe ad esercitare un pregiudizio verso l’ipotesi nulla, in quanto le diagnosi nel gruppo “non vaccinato” potrebbero invece essere quelle del gruppo vaccinato.
Infine, le stime degli effetti in questo articolo erano generalmente superiori a 2,0. Quindi, affinché qualche cofondatore possa spiegare questa associazione, dovrebbe essere due volte più frequente nei bambini vaccinati.34
Limitazioni di potenziale
Il principale punto debole di questo studio è l’uso di un campione di convenienza di tre diverse pratiche pediatriche. Inoltre, la dimensione del campione, anche se sufficiente per alcune diagnosi, come le cinque principali condizioni studiate, era troppo piccola per l’analisi di condizioni con prevalenza più bassa, come l’autismo. Inoltre, questo campione potrebbe non rappresentare con precisione una sezione trasversale dei bambini statunitensi, data la bassa incidenza di autismo (0,5%) e di ADD/ADHD (0,7%) rispetto alle incidenze osservate a livello nazionale (rispettivamente all’1,7%35 e tra il 5% e il 9%,36). Inoltre, l’assorbimento del vaccino, che è circa il 95% a livello nazionale, è piuttosto basso in queste pratiche e può riflettere le differenze demografiche tra il campione dello studio e la popolazione generale. Inoltre, a causa delle diverse pratiche di codifica tra i tre casi studiati, non siamo stati in grado di differenziare i tipi di vaccini somministrati. Ciò ha limitato l’analisi al conteggio del numero di vaccinazioni ricevute per 1 anno di età.
Il basso livello di assorbimento complessivo di vaccini in queste pratiche (media = 8,9 vaccini per 1 anno di età) ci impedisce di fare un confronto tra bambini completamente vaccinati e non vaccinati all’interno di questa coorte. Inoltre, l’età media alla prima dose di vaccino nella coorte era di 81 giorni (poco meno di 3 mesi) rispetto al vaccino contro l’epatite B che è raccomandato entro 24 ore dalla nascita. La cartella clinica non includeva fattori demografici specifici che possono essere associati a esiti sanitari, tra cui lo stato socioeconomico, l’educazione materna, l’età gestazionale alla nascita, il punteggio di Aspetto, Polso, Smorfia, Attività e Respirazione (APGAR), il tipo di nascita e la durata dell’allattamento al seno, tra gli altri. L'”ipotesi dell’igiene” ha mostrato le relazioni tra il tipo di nascita/allattamento al seno e le allergie, l’asma e l’eczema.37,38 Ci sono indubbiamente differenze demografiche all’interno dei due gruppi studiati (vaccinati contro non vaccinati), soprattutto per quanto riguarda lo status socio-economico e l’educazione materna. Secondo Smith et al.,39 le madri di famiglie in cui i vaccini sono stati ritardati e rifiutati tendevano ad avere un livello di istruzione universitaria più elevato e le famiglie erano più benestanti. Sebbene non esistano studi diretti sull’età gestazionale alla nascita nelle famiglie vaccinate rispetto a quelle non vaccinate, Zerbo et al.40 hanno indicato che i bambini nati da donne che hanno ricevuto il vaccino antinfluenzale durante la gravidanza avevano un’età gestazionale significativamente più alta. Dueker et al.41 hanno dimostrato che ogni settimana di età gestazionale oltre le 35-41 settimane ha diminuito significativamente i ritardi di sviluppo nei neonati. Inoltre, anche i bambini nati prematuri (34-37 settimane) hanno mostrato un tasso più elevato di ospedalizzazione per asma.42
E’ stato anche difficile discernere il comportamento di ricerca di assistenza sanitaria tra le famiglie di bambini vaccinati contro i bambini non vaccinati al di fuori della valutazione della diagnosi di controllo, trauma cranico, che ha mostrato significato solo all’interno di un gruppo nell’analisi temporale. Le tre pratiche mediche partecipanti raccomandavano che tutti i bambini andassero a visitare i bambini benestanti, indipendentemente dal fatto che ricevessero o meno i vaccini. Tuttavia, nessuno degli studi medici ha conservato dati sulla frequenza delle visite. Se a questi controlli si presentasse un numero maggiore di bambini vaccinati rispetto a quelli non vaccinati, ciò sarebbe indicativo di una differenza nel comportamento di ricerca di assistenza sanitaria e potrebbe portare a un maggior numero di diagnosi nel gruppo che è stato visto più spesso dal medico. C’era una percentuale più alta di bambini non vaccinati nel campione complessivo rispetto a quelli inclusi nell’analisi principale, il che potrebbe essere indicativo di un diverso comportamento di ricerca di assistenza sanitaria. Tuttavia, il campione complessivo comprendeva bambini esclusi dall’analisi principale perché più giovani di quanto consentito dallo studio (Grafico 1). Molti di questi bambini sono stati classificati come non vaccinati prima della loro esclusione, anche se il loro vero status di vaccinazione era indeterminato in quanto non avevano ancora raggiunto l’età di 1 anno (e 15 giorni). Ciò ha avuto l’effetto di gonfiare artificialmente la proporzione di bambini non vaccinati nel campione complessivo.
Glanz et al.43 hanno riferito che i bambini sottovaccinati hanno mostrato tassi significativamente più bassi di visite mediche ambulatoriali (rapporto di rischio di incidenza = 0,89, 95% CI 0,89-0,90) all’interno di un grande studio di coorte retrospettivamente abbinato che coinvolge il CDC Vaccine Safety Datalink. Tuttavia, in questo studio, sono state osservate relazioni coerenti all’interno di tre delle condizioni di salute considerate rispetto al significato marginale visto per il trauma cranico in una sola analisi che coinvolge un sottogruppo della coorte. Le famiglie che frequentano la scuola a domicilio hanno dimostrato di avere tassi di vaccinazione più bassi44 che possono anche contribuire a differenze nel comportamento di ricerca di assistenza sanitaria, dato che i bambini che frequentano la scuola a domicilio potrebbero essere sottodiagnosticati. Questo tipo di dati demografici non era disponibile per l’analisi.
Studi recenti hanno dimostrato che alcuni vaccini hanno effetti non specifici che aumentano o diminuiscono la suscettibilità alle malattie infettive non bersaglio del vaccino. Il vaccino più recente somministrato esercita il maggiore effetto. I vaccini vivi, come il morbillo, il MMR e il Bacillus Calmette-Guérin (BCG), tendono a ridurre il rischio (fornendo un’influenza protettiva), mentre i vaccini non vivi, come l’epatite B,11 DTP e la poliomielite inattiva (IPV), tendono ad aumentare il rischio. Ad esempio, Bardenheier et al.12 hanno trovato un rischio minore di ricoveri per malattie infettive non mirate tra i bambini il cui ultimo vaccino ricevuto è stato vivo rispetto al vaccino inattivato (hazard ratio (HR) = 0.50, 95% CI 0.43-0.57). In una recente meta-analisi condotta da Aaby et al.,13 ragazze che hanno ricevuto un vaccino inattivato dopo aver ricevuto un vaccino contro il morbillo avevano una probabilità significativamente maggiore di morire per altre cause rispetto alle ragazze che hanno ricevuto un vaccino inattivato prima di ricevere un vaccino contro il morbillo (rapporto di mortalità (MRR) = 1,89, 95% CI 1,27-2,80). Sebbene questo studio attuale non abbia preso in considerazione effetti non specifici (a causa delle differenze nel modo in cui i tre pediatri hanno registrato i dati dei pazienti), è possibile che il vaccino più recente somministrato abbia potuto influenzare i risultati.
Non è stato fatto alcuno sforzo per valutare i bambini che potrebbero aver perso la diagnosi di disturbi cronici, come il ritardo dello sviluppo e l’asma. Tuttavia, secondo il CDC, le disabilità dello sviluppo “di solito durano per tutta la vita”.45 Anche l’asma è normalmente una condizione cronica che dura tutta la vita.46 Poiché perdere queste diagnosi è raro, è improbabile che ciò abbia influito sui risultati.
Conclusione
In questo studio, basato su un campione di bambini nati in uno dei tre diversi studi medici pediatrici, sono state osservate sale operatorie più alte all’interno del gruppo vaccinato rispetto a quello non vaccinato per ritardi dello sviluppo, asma e infezioni dell’orecchio. Non è stata trovata alcuna associazione per disturbi gastrointestinali nell’analisi primaria, ma è stata rilevata una relazione significativa nel terzo e quarto quartile (dove sono state somministrate più dosi di vaccino), al cut-off di 6 mesi nell’analisi temporale, e quando il tempo consentito per una diagnosi è stato esteso dai bambini ⩾ di 3 anni ai bambini ⩾ di 5 anni. Risultati simili sono stati osservati in studi precedenti di Mawson et al.3 e Delong.20 I risultati di questo studio devono essere valutati in base ai punti di forza e ai limiti dei dati disponibili e al disegno dello studio, che permetteva solo il calcolo delle associazioni osservazionali non corrette. Ulteriori ricerche che utilizzano un campione più ampio di una varietà di pratiche mediche pediatriche produrranno una maggiore certezza dei risultati e consentiranno l’indagine di condizioni di salute con prevalenza più bassa, come l’autismo. Una valutazione approfondita delle popolazioni vaccinate rispetto a quelle non vaccinate è essenziale per comprendere l’intero spettro degli effetti sulla salute associati a specifici vaccini e il programma vaccinale infantile nel suo complesso.
Riconoscimenti
Gli autori ringraziano il dottor David Rice III (professore assistente di biologia della Simpson University) per l’assistenza esperta nella configurazione preliminare del database dei pazienti. Ringraziano anche la dott.ssa Beatrice Golomb (Professore di Medicina, Università della California, San Diego) per la sua revisione critica del progetto originale dello studio.
Dichiarazione di conflitto di interessi
Gli autori hanno dichiarato i seguenti potenziali conflitti di interesse in relazione alla ricerca, alla paternità e/o alla pubblicazione di questo articolo: Il dottor Hooker è un consulente scientifico retribuito e fa parte del comitato consultivo di Focus for Health (ex Focus Autismo). Fa anche parte del Consiglio di Amministrazione per la Difesa della Salute dei Bambini (ex World Mercury Project) ed è un imprenditore indipendente retribuito della Difesa della Salute dei Bambini. Il dottor Hooker è il padre di un uomo di 22 anni a cui è stato diagnosticato un autismo e ritardi nello sviluppo. Il signor Miller è il direttore del Thinktwice Global Vaccine Institute ed è stato un consulente retribuito di Medici per il consenso informato.
Approvazione etica
L’approvazione etica di questo studio è stata revocata dal Simpson University Institutional Review Board perché il progetto di ricerca di cui sopra soddisfa le condizioni per l’esenzione ai sensi del 45 CFR 46.101(b)(4). Tutti i dati esistono a partire dal 1° giugno 2018 e le informazioni saranno registrate in modo tale che i soggetti non possano essere identificati, direttamente o tramite identificatori collegati ai soggetti. Gli autori hanno inoltre confermato che i risultati di questo studio non saranno presentati alla Food and Drug Administration (FDA) per l’approvazione della commercializzazione.
Finanziamento
L’autore o gli autori non hanno ricevuto alcun sostegno finanziario per la ricerca, la paternità e/o la pubblicazione di questo articolo.
Consenso informato
Per questo studio non è stato richiesto il consenso informato in quanto tutti i dati esistono dal 1° giugno 2018 e le informazioni sono state registrate in modo tale che i soggetti non possono essere identificati, direttamente o tramite identificatori collegati ai soggetti.
References
| 1. | Centers for Disease Control and Prevention (CDC) . Ten great public health achievements—United States 1900-1999. Morb Mortal Wkly Rep 1999; 48: 241–243. Google Scholar | Medline |
| 2. | Robinson, CL, Romero, JR, Kempe, A, et al. Advisory Committee on Immunization Practices recommended immunization schedule for children and adolescents aged 18 years or young—United States. Morb Mortal Wkly Rep 2018; 67: 156–157. Google Scholar | Crossref | Medline |
| 3. | Mawson, AR, Ray, BD, Bhuiyan, AR, et al. Pilot comparative study on the health of vaccinated and unvaccinated 6- to 12-year-old U.S. children. J Transl Sci 2017; 3: 1–12. Google Scholar |
| 4. | Kuter, BJ, Brown, M, Wiedmann, RT, et al. Safety and immunogenicity of M-M-RII (Combination Measles-Mumps-Rubella Vaccine) in clinical trials of healthy children conducted between 1988 and 2009. Pediatr Infect Dis J 2016; 35(9): 1011–1020. Google Scholar | Crossref | Medline |
| 5. | Institute of Medicine . Adverse effects of vaccines: evidence and causality. Washington, DC: The National Academies Press, 2011. Google Scholar |
| 6. | Gold, MS, Balakrishnan, MR, Amarasinghe, A, et al. An approach to death as an adverse event following immunization. Vaccine 2016; 34(2): 212–217. Google Scholar | Crossref | Medline |
| 7. | Pollard, AJ. Childhood immunisation: what is the future? Arch Dis Child 2007; 92: 426–433. Google Scholar | Crossref | Medline |
| 8. | Institute of Medicine . The childhood immunization schedule and safety: stakeholder concerns, scientific evidence, and future studies. Washington, DC: The National Academies Press, 2013. Google Scholar |
| 9. | Institute of Medicine . Immunization safety review: vaccinations and sudden unexpected death in infancy. Washington, DC: The National Academies Press, 2003. Google Scholar |
| 10. | Institute of Medicine . Immunization safety review: multiple immunizations and immune dysfunction. Washington, DC: The National Academies Press, 2002. Google Scholar |
| 11. | Garly, ML, Jensen, H, Martins, CL, et al. Hepatitis B vaccination associated with higher female than male mortality in Guinea-Bissau: an observational study. Pediatr Infect Dis J 2004; 23(12): 1086–1092. Google Scholar | Medline |
| 12. | Bardenheier, BH, McNeil, MM, Wodi, AP, et al. Risk of nontargeted infectious disease hospitalizations among US children following inactivated and live vaccines, 2005-2014. Clin Infect Dis 2017; 65(5): 729–737. Google Scholar | Crossref | Medline |
| 13. | Aaby, P, Ravn, H, Benn, CS, et al. Randomized trials comparing inactivated vaccine after medium- or high-titer measles vaccine with standard titer measles vaccine after inactivated vaccine: a meta-analysis. Pediatr Infect Dis J 2016; 35(11): 1232–1241. Google Scholar | Crossref | Medline |
| 14. | Nilsson, L, Kjellman, NI, Björkstén, B. A randomized controlled trial of the effect of pertussis vaccines on atopic disease. Arch Pediatr Adolesc Med 1998; 152(8): 734–738. Google Scholar | Crossref | Medline |
| 15. | Anderson, HR, Poloniecki, JD, Strachan, DP, et al. Immunization and symptoms of atopic disease in children: results from the International Study of Asthma and Allergies in Childhood. Am J Public Health 2001; 91(7): 1126–1129. Google Scholar | Crossref | Medline |
| 16. | Yon, DK, Ha, EK, Lee, S, et al. Hepatitis B immunogenicity after a primary vaccination course associated with childhood asthma, allergic rhinitis, and allergen sensitization. Pediatr Allergy Immunol 2018; 29(2): 221–224. Google Scholar | Crossref | Medline |
| 17. | Hurwitz, EL, Morgenstern, H. Effects of diphtheria-tetanus-pertussis or tetanus vaccination on allergies and allergy-related respiratory symptoms among children and adolescents in the United States. J Manipulative Physiol Ther 2000; 23: 81–90. Google Scholar | Crossref | Medline |
| 18. | Zhang, JL, Ma, Z, Sun, WW, et al. Programmed vaccination may increase the prevalence of asthma and allergic diseases. Am J Rhinol Allergy 2016; 30(4): 113–117. Google Scholar | SAGE Journals |
| 19. | Institute of Medicine . Immunization safety review: thimerosal-containing vaccines and neurodevelopmental disorders. Washington, DC: The National Academies Press, 2001. Google Scholar |
| 20. | Delong, G. A positive association found between autism prevalence and childhood vaccination uptake across the U.S. population. J Toxicol Environ Health A 2011; 74: 903–916. Google Scholar | Crossref | Medline |
| 21. | Gallagher, C, Goodman, M. Hepatitis B triple series vaccine and developmental disability in U.S. children aged 1-9 years. Toxicol Environ Chem 2008; 90: 997–1008. Google Scholar | Crossref |
| 22. | Geier, DA, Kern, JK, Homme, KG, et al. Abnormal brain connectivity spectrum disorders following thimerosal administration: a prospective longitudinal case-control assessment of medical records in the vaccine safety datalink. Dose Response 2017; 15(1): 1–12. Google Scholar | SAGE Journals |
| 23. | Geier, DA, Kern, SK, Hooker, BS, et al. A longitudinal cohort study of the relationship between thimerosal-containing hepatitis b vaccination and specific delays in development in the United States: assessment of attributable risk and lifetime care costs. J Epidemiol Glob Health 2016; 6(2): 105–118. Google Scholar | Crossref | Medline | ISI |
| 24. | Geier, DA, Kern, JK, King, PG, et al. The risk of neurodevelopmental disorders following a Thimerosal-preserved DTaP formulation in comparison to its Thimerosal-reduced formulation in the Vaccine Adverse Event Reporting System (VAERS). J Biochem Pharmacol Res 2014; 2(2): 64–73. Google Scholar |
| 25. | Wilson, K, Ducharme, R, Ward, B, et al. Increased emergency room visits or hospital admissions in females after 12-month MMR vaccination, but no difference after vaccinations given at a younger age. Vaccine 2014; 32: 1153–1159. Google Scholar | Crossref | Medline |
| 26. | Merck & Co., Inc . RotaTeq (Rotavirus Vaccine, Live, Oral, Pentavalent) (Product insert 2017; Table 5: 6). Whitehouse Station, NJ: Merck & Co., Inc. Google Scholar |
| 27. | Fine, PE, Chen, RT. Confounding in studies of adverse reactions to vaccines. Am J Epidemiol 1992; 136: 121–135. Google Scholar | Crossref | Medline | ISI |
| 28. | Haber, P, Parashar, UD, Haber, M, et al. Intussusception after monovalent rotavirus vaccine—United States, vaccine adverse event reporting system (VAERS), 2008-2014. Vaccine 2015; 33(38): 4873–4877. Google Scholar | Crossref | Medline |
| 29. | Yih, WK, Lieu, TA, Kulldorff, M, et al. Intussusception risk after rotavirus vaccination in U.S. infants. N Engl J Med 2014; 370(6): 503–512. Google Scholar | Crossref | Medline |
| 30. | Carlin, JB, Macartney, KK, Lee, KJ, et al. Intussusception risk and disease prevention associated with rotavirus vaccines in Australia’s National Immunization Program. Clin Infect Dis 2013; 57(10): 1427–1434. Google Scholar | Crossref | Medline |
| 31. | Weintraub, ES, Baggs, J, Duffy, J, et al. Risk of intussusception after monovalent rotavirus vaccination. N Engl J Med 2014; 370(6): 513–519. Google Scholar | Crossref | Medline | ISI |
| 32. | Nzolo, D, Ntetani Aloni, M, Mpiempie Ngamasata, T, et al. Adverse events following immunization with oral poliovirus in Kinshasa, Democratic Republic of Congo: preliminary results. Pathog Glob Health 2013; 107(7): 381–384. Google Scholar | Crossref | Medline |
| 33. | Geier, DA, Geier, MR. Quadrivalent human papillomavirus vaccine and autoimmune adverse events: a case-control assessment of the vaccine adverse event reporting system (VAERS) database. Immunol Res 2017; 65(1): 46–54. Google Scholar | Crossref | Medline |
| 34. | Cornfield, J, Haenszel, W, Hammond, EC, et al. Smoking and lung cancer: recent evidence and a discussion of some questions. J Natl Cancer Inst 1959; 22(1): 173–203. Google Scholar | Medline |
| 35. | Centers for Disease Control and Prevention (CDC) . Prevalence of autism spectrum disorder among children aged 8 years—autism and developmental disabilities monitoring network, 11 sites, United States, 2014. MMWR Surveill Summ 2018; 67(6): 1–23. Google Scholar | Crossref |
| 36. | American Psychiatric Association . Diagnostic and statistical manual of mental disorders, fifth edition: DSM-5. Washington, DC: American Psychiatric Association, 2013. Google Scholar | Crossref |
| 37. | Neu, J, Rushing, J. Cesarean versus vaginal delivery: long-term infant outcomes and the hygiene hypothesis. Clin Perinatol 2011; 38(2): 321–331. Google Scholar | Crossref | Medline | ISI |
| 38. | Johnson, CC, Ownby, DR. The infant gut bacterial microbiota and risk of pediatric asthma and allergic diseases. Transl Res 2017; 179: 60–70. Google Scholar | Crossref | Medline |
| 39. | Smith, PJ, Humiston, SG, Marcuse, EK, et al. Parental delay or refusal of vaccine doses, childhood vaccination coverage at 24 months of age, and the health belief model. Public Health Rep 2011; 126(Suppl. 2): 135–146. Google Scholar | SAGE Journals | ISI |
| 40. | Zerbo, O, Qian, Y, Yoshida, C, et al. Association between influenza infection and vaccination during pregnancy and risk of autism spectrum disorder. JAMA Pediatr 2017; 171(1): e163609. Google Scholar | Crossref | Medline |
| 41. | Dueker, G, Chen, J, Cowling, C, et al. Early developmental outcomes predicted by gestational age from 35 to 41 weeks. Early Hum Dev 2016; 103: 85–90. Google Scholar | Crossref | Medline |
| 42. | Leung, JY, Lam, HS, Leung, GM, et al. Gestational age, birthweight for gestational age, and childhood hospitalisations for asthma and other wheezing disorders. Paediatr Perinat Epidemiol 2016; 30(2): 149–159. Google Scholar | Crossref | Medline |
| 43. | Glanz, JM, Newcomer, SR, Narwaney, KJ, et al. A population-based cohort study of undervaccination in 8 managed care organizations across the United States. JAMA Pediatr 2013; 167(3): 274–281. Google Scholar | Crossref | Medline |
| 44. | Mohanty, S, Joyce, CM, Delamater, PL, et al. Homeschooling parents in California: attitudes, beliefs and behaviors associated with child’s vaccination status. Vaccine 2020; 38: 1899–1905. Google Scholar | Crossref | Medline |
| 45. | Centers for Disease Control and Prevention (CDC) . Facts about developmental disabilities, https://www.cdc.gov/ncbddd/developmentaldisabilities/facts.html (accessed 30 March 2020). Google Scholar |
| 46. | Centers for Disease Control and Prevention (CDC) . You can control your asthma, https://www.cdc.gov/nceh/features/asthmaawareness/ (accessed 30 March 2020). Google Scholar |
 quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere
quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere