Traslocazione e persistenza biologica nel cervello dell’alluminio utilizzato come adiuvante nei vaccini
05 Febbraio 2015.
Autori: Romain Kroum Gherardi, Housam Eidi , Guillemette Crépeaux, François Jerome Authier e Josette Cadusseau.
Abstract (riassunto):
L’ossi-idrossido di alluminio (corrispondente a solfato di alluminio e potassio dodecaidrato, con formula chimica KAl(SO4)2*12H2O è un composto cristallino ampiamente utilizzato come adiuvante nei vaccini, ed a seguito dell’utilizzo delle particelle di tale composto sono emerse preoccupazioni legate al loro ruolo di innesco nella c.d. Fibromialgia Macrofagica (in inglese macrophagic myofasciitis o MMF): in soggetti predisposti affetti da encefalomielite mialgica/sindrome da stanchezza cronica (in inglese Myalgic Encephalomyelitis/Chronic Fatigue Syndrome o ME/CFS) è stata riscontrata un’inaspettatamente prolungata persistenza biologica del suddetto composto all’interno delle cellule immunitarie.
È stato precedentemente dimostrato che le particelle di ossi-idrossido di alluminio, dalla caratteristica d’essere scarsamente biodegradabili, una volta iniettate nel muscolo vengono prontamente fagocitate e possono giungere (trasportate dal e nel sistema linfatico, all’interno delle cellule fagocitiche) in tutto l’organismo, per poi accumularsi lentamente nel cervello.
Questo suggerisce fortemente che la persistenza biologica a lungo termine del suddetto adiuvante all’interno delle cellule fagocitiche è prerequisito di una lenta traslocazione finale nel cervello e di neurotossicità ritardata La comprensione dei meccanismi di base della persistenza biologica delle particelle di ossi-idrossido di alluminio e relativa traslocazione nel cervello rappresenta una sfida importante per la salute, poiché potrebbe esser d’aiuto nel definire quali siano i fattori di suscettibilità che portano allo sviluppo di danni neurotossici cronici.
La persistenza biologica di tali particelle può essere collegata al suo “effetto-destabilizzante-sui-lisosomi”, che è probabilmente causata dalla rottura diretta indotta delle membrane fagolisosomali.
... leggi tuttoI macrofagi che intercettano e catturano nel loro citoplasma in continuazione particelle estranee apprendono e ripetono -probabilmente con efficienza individuale variabile- una forma particolare e propria di autofagia antibatterica (**): le particelle all’interno della doppia membrana degli autofagosomi e la loro successiva fusione con i lisosomi ri-acidificati riparati espongono le particelle di ossiidrossido di alluminio ad un pH lisosomiale acido, fattore unico questo che può renderle solubili.
La loro traslocazione nel cervello è quindi correlata ad un meccanismo come quello del cavallo di Troia, descritto in precedenza per le particelle infettive (HIV, HCV), il quale obbedisce al gene CCL2 (***), trasmettendo così informazioni e/o istruzioni ai principali monociti infiammatori chemotattici, attivando di conseguenza la chemotassi (fenomeno biologico consistente nella migrazione attiva di cellule verso concentrazioni crescenti di una sostanza chimica, o attrattore chemotattico, quale può esser ad esempio un nutriente).
La membrana esterna autofagosoma alla fine si fonde coi lisosomi: i geni di tutte le molecole facenti parte del meccanismo di autofagocitosi sono soggetti a delle modifiche strutturali attualmente constatabili nei pazienti affetti da fibromialgia macrofagica.
Recenti evidenze sostengono un ruolo sempre più importante per il percorso di autofagia delle difese immunitarie innate contro patogeni intracellulari, come un meccanismo di cattura di entrambi i tipi di batteri (citosolici o vacuolari) che vengono reindirizzati al vano lisosomiale per esser eliminati. La c.d. autofagia antibatterica (in inglese xenophagy) comporta il riconoscimento selettivo di batteri intracellulari e del loro obiettivo verso il meccanismo autofagico per la degradazione.
In questo studio scientifico vengono passati in rassegna i recenti progressi nella comprensione molecolare di questi processi, e nel modo in cui i batteri si sono adattati per evitare l’autofagia antibatterica oppure per approfittare di questo processo immunitario innato.
Miliardi di esseri umani sono stati vaccinati, ed alle vaccinazioni viene associata la regressione o l’eradicazione di varie malattie infettive gravi.
Al giorno d’oggi, le potenziali applicazioni dei vaccini vanno ben oltre la prevenzione di patologie infettive, e la vaccinazione è considerata un’arma promettente contro una varietà di affezioni diverse. La sicurezza di questa pratica medica è stata considerata come eccellente per quanto riguarda la popolazione (1), eppure sono anche stati riportati effetti avversi (2).
Le preoccupazioni circa l’utilizzo delle particelle di ossi-idrossido di alluminio come adiuvante sono emerse a seguito del riconoscimento del loro ruolo all’origine della c.d. fibromialgia macrofagica (in inglese macrophagic myofasciitis o MMF) nel 2001 (3, 4), che ha portato alla luce il fondamentale malinteso del loro effetto come adiuvante ed ha sottolineato una loro persistenza biologica di inaspettata lunga durata (4), oltre alla dimostrazione (ii) della loro capacità di migrar in organi linfoidi per poi diffondersi in tutto il corpo all’interno di monociti e macrofagi, per accumularsi infine progressivamente nel cervello (5).
Questo studio scientifico esamina le caratteristiche emergenti delle particelle di ossi-idrossido di alluminio, composto ampiamente utilizzato come adiuvante nei vaccini, che sollevano preoccupazioni per quanto riguarda la loro (presunta) innocuità.
Destabilizzazione dei lisosomi causata dalle particelle di ossi-idrossido di alluminio
Gli adiuvanti sono stati utilizzati nei vaccini per la loro capacità di migliorare la risposta immunitaria adattativa per un antigene co-somministrato. I sali di alluminio particolato (noti come ossi-idrossido di alluminio) sono stati i principali adiuvanti approvati per l’utilizzo nei vaccini per gli esseri umani, ed il loro impiego perdura da oltre 80 anni (6): sono attualmente utilizzati nei vaccini contro il tetano, l’epatite A, l’epatite B, il papillomavirus umano, l’haemophilus influenzae B, lo pneumococco e meningococco e persino quello contro l’antrace. L’alluminio viene aggiunto come adiuvante ai vaccini nelle principali forme di ossi-idrossido di alluminio, un composto cristallino, idrossifosfato di alluminio ed idrossifosfato amorfo di alluminio solfato L’ossi-idrossido di alluminio è in grado di assorbire gli antigeni vaccinali sulla sua superficie: un così potente assorbimento risulta dallo scambio legante, che prevede la sostituzione di uno ione ossidrile di superficie dell’adiuvante con un gruppo fosfato terminale dell’antigene (7)
... leggi tutto
I sali di alluminio particolato (noti come ossi-idrossido di alluminio) inducono forti risposte immunitarie innate nel sito di inoculazione, come valutato dal rapido afflusso di neutrofili, monociti, macrofagi, eosinofili, cellule presentanti antigene MHC-II+ e cellule dendritiche (in inglese Dentritic Cells o Dcs (8)). I macrofagi residenti principalmente nelle fibrille muscolari sono fra le prime cellule a percepire i disturbi dell’omeostasi muscolare (9).
Le cellule dendritiche avvertono ed allertano il sistema immunitario attraverso la produzione locale di chemochine e reclutano altre cellule mieloidi, come neutrofili e monociti infiammatori che si differenziano in cellule dendritiche infiammatorie (9): specializzati per l’assorbimento dell’antigene, i monociti infiammatori derivanti da cellule dendritiche presentano un fenotipo immaturo nel muscolo.
Tuttavia, le cellule dendritiche migrano fino alla paracorteccia dei linfociti-T a contatto coi residui di tessuto o materiale estraneo, ed arrivano lì come cellule mature che esprimono molecole co-stimolatorie (10). Le cellule dendritiche infiammatorie possono essere cruciali per l’attività dell’ossi-idrossido di alluminio come adiuvante valutata da studi di deplezione selettiva (11), ma anche gli eosinofili sembrano avere un ruolo importante (12).
Ai sali di alluminio è stata a lungo associata l’idea di poter assicurare una risposta immunitaria duratura grazie al c.d. “effetto depot”, cioè tramite il lento rilascio dell’antigene sotto l’influenza del liquido interstiziale (13, 14). In contrasto col precedente punto di vista, per cui l’adiuvante impiegato rimaneva solo a livello extracellulare, la biopsia muscolare nei pazienti sottoposti a profilassi vaccinale con vaccini adiuvati con particelle di ossi-idrossido di alluminio (4) ha evidenziato che queste sono rapidamente ed ‘avidamente’ assimilate dai fagociti al loro interno (15). Il forte legame dell’antigene con le particelle di tale adiuvante aumenta l’assorbimento dell’antigene da parte delle cellule dendritiche, riduce il deterioramento degli antigeni, e sostiene la presentazione dell’antigene in vitro (16). L’assorbimento di particelle di ossi-idrossido di alluminio, piuttosto che indurne la morte, favorisce la sopravvivenza degli stessi macrofagi (17): il loro ‘comportamento’ viene modificato, venendo indotti dall’adiuvante a percepire continuamente particelle estranee nel loro citoplasma, come se si trattasse di organelli senescenti oppure batteri, ed a reiterare il processo autofagico sino a che dispongono di materiale estraneo.
L’iniezione di ossi-idrossido di alluminio in vivo induce la formazione di granuloma indotto dalle relative particelle persistente nel sito di inoculazione del vaccino (4, 18, 19). Tuttavia, per una buona immunizzazione è superflua la persistenza delle particelle di ossi-idrossido di alluminio localmente, dal momento che alcuna diminuzione di risposta immunitaria all’antigene specifico da parte di linfociti T e B è stata osservata in caso di rimozione di tale adiuvante dal sito di inoculazione già fin da sole due ore dopo l’iniezione (20).
Nonostante il loro uso prolungato, la letteratura ha evidenziato che i meccanismi dei sali di alluminio impiegati come adiuvanti nei vaccini sono e rimangono sostanzialmente sconosciuti, nonostante una più attiva indagine nel settore avvenuta negli ultimi anni (21, 22). L’ossi-idrossido di alluminio è insufficiente ad avviare una risposta immunitaria cellulo-mediata: distorce la risposta immunitaria attivando i linfociti T helper (Th2) ed inducendo quindi una cospicua produzione di interleuchina 4 (nota anche come IL-4) -la cui principale funzione è quella di regolare le reazioni immunomediate da IgE e mastociti/eosinofili, stimolare la produzione di Ig da parte dei linfociti B verso la produzione di IgE, stimolare la crescita e la duplicazione dei linfociti T, in specificoTh2; è una citochina- attivando la produzione del sottotipo d’anticorpi IgG1 (23).
Per quanto riguarda i meccanismi dell’ossi-idrossido di alluminio come adiuvante, sono state proposte diverse spiegazioni, di cui la maggior parte sono state in seguito contestate (24). In particolare, l’inflammasome NLRP3 ha dimostrato di essere fortemente attivato dalle particelle di ossi-idrossido di alluminio impiegate come adiuvante nei vaccini (25, 26), ma questo sembra infine non-essenziale all’effetto adiuvante (27, 28) mentre resta vero, tuttavia, che l’ossi-idrossido di alluminio ed altri cristalli come silice, sodio urato e amianto inducono fortemente attivazione dell’infIammasone NLRP3, rilascio d’interleuchina 1B (nota anche come IL-1B) attivazione del meccanismo infiammatorio nella sua totalità.
Più recentemente, modelli alternativi d’immunità mediata, ottenuta grazie alle particelle di ossi-idrossido di alluminio sono stati proposti sulla base della famigliarità degli effetti e quindi del rilascio di biomolecole non citochine, fra cui acido urico (29), DNA a doppio filamento (30) e prostaglandina E2 (31).
La specificità della reazione immunitaria indotta da tale composto cristallino è stata proposta come spiegazione della ragione per cui le particelle di idrossido di alluminio presentano un effetto molto più irritante dell’alluminio solubile (32). Coerentemente, i cristalli di ossi-idrossido di alluminio aggrediscono e si legano a doppio strato alla membrana plasmatica dei lipidi (33), destabilizzano i lisosomi che degradano i materiali estranei tramite endocitosi, fagocitosi o autofagocitosi (34, 35) e giocano un ruolo importante nel sistema immunitario: le funzioni di elaborazione dell’antigene delle cellule dendritiche utilizzano proteasi lisosomiali e variazioni di pH ottimali per la generazione di peptidi, piuttosto che la degradazione delle proteine complete (36). È noto che la limitazione della protolisi lisosomiale delle proteine antigeniche aumenta presentazione dell’antigene, immunogenicità (37), e stabilità dei complessi pepticidi MHCII, i quali si accumulano sulla superficie delle cellule dendritiche grazie all’inibizione dell’attività dei lisosomi (38). I meccanismi innescati dall’ossi-idrossido di alluminio possono quindi comportare per i lisosomi il blocco e/o la destabilizzazione, sulla cui causa effettiva vi è tuttavia ancora incertezza, mentre per quanto riguarda la rottura fisica della membrana vi è certezza che sia causata direttamente dalla struttura cristallina dei sali d’alluminio stessi (39).
Fibromialgia: marker per la valutazione della presenza di ossi-idrossido d’alluminio
Nel 1998, diversi miopatologi francesi descrissero la fibromialgia macrofagica (in inglese macrophagic myofasciitis o MMF) come «una condizione emergente dalle cause sconosciute caratterizzata da lesioni patognomoniche (quando vengono riscontrate sono indicative di un’unica dermatosi, e si tratta solitamente di cavità scavate nello strato corneo) nella biopsia muscolare che presentavano grandi macrofagi con agglomerati di nanocristalli di dimensioni da sub-micron a micron nel loro citoplasma ed inclusioni linfocitarie (3), distinte da altre patologie istiocitiche sempre rilevate nel deltoide muscolare degli adulti (40)». Inclusioni citoplasmatiche sono state costantemente trovate, circondate o meno da membrane lisosomiali alterate e contenenti alluminio (4): la struttura cristallina era caratteristica delle particelle di ossi-idrossido di alluminio, seppure alcuna esposizione all’alluminio diversa e/o precedente da quella attribuita al 100% ad una vaccinazione preventiva sia stata sin d’ora rilevata (4).
... leggi tutto
Pare ormai chiaro che il rapido esordio di fibromialgia macrofagica avvenuto in Francia riflette la combinazione (i) della sostituzione dai vaccini ad inoculazione sottocutanea (sc) con quelli per via intramuscolare (im) nei primi anni ’90; (ii) la grande campagna vaccinale per adulti in Francia come prima (presunta) immunizzazione contro l’epatite B a metà degli anni ’90 e (iii) la scelta preferenziale del muscolo deltoide per effettuare la biopsia di routine in Francia, in contrasto con l’uso preferenziale dei bicipiti brachiali e dei quadricipiti in altri paesi. I vaccini contenenti particelle di ossi-idrossido di alluminio possono indurre pseudo-linfoma della pelle negli esseri umani (41) e fibrosarcoma nei gatti (42).
Le fibromialgie macrofagiche sono state riprodotte sperimentalmente tramite l’inoculazione di vaccini (con sali d’alluminio come adiuvanti) per via intramuscolare effettuata su ratti e scimmie (4, 18, 19). La lesione sperimentale si riduce invariabilmente nel tempo (19), e nelle scimmie inizia a scomparire completamente dai muscoli fra i 6 ed i 12 mesi dopo l’inoculazione del vaccino DTP, contenente sali d’alluminio come adiuvante in quantità equivalente da 14 a 21 volte quella presente nei vaccini per gli esseri umani (18).
A causa della non-eticità di effettuare una biopsia muscolare in soggetti asintomatici, è impossibile determinare direttamente una forma nascosta di fibromialgia macrofagica, anche con esordio di molto anteriore nel tempo! Tale patologia può essere comunemente presente in forma silente in individui sani: questo sembra tuttavia molto improbabile, come indicato in una recente revisione di 130 biopsie consecutive del muscolo deltoide eseguite a scopo diagnostico in pazienti mialgici precedentemente immunizzati con vaccini contenenti ossi-idrossido di alluminio come adiuvante. Questo studio ha rivelato che la maggior parte di coloro che sono stati sottoposti a tali vaccinazioni sembrano affetti da fibromialgia macrofagica non-duratura; questo potrebbe essere valutato in modo attendibile considerando fattori quali: età, rapporto fra i sessi, numero di inoculazioni di vaccini contenenti ossi-idrossido di alluminio, tempo trascorso dall’ultima inoculazione nel muscolo deltoide.
Dato che questi dati erano simili nei gruppi di pazienti affetti e non da fibromialgia macrofagica (43), è stata smentita la convinzione non documentata che ogni persona vaccinata potesse essere affetta da fibromialgia in forma silente, effettuando la biopsia nel muscolo deltoide (44).
Alla luce di modelli sperimentali, è importante controllare il singolo dato in ogni paziente per valutare il carattere “insolitamente persistente” della fibromialgia macrofagica: in una recente valutazione di una raccolta di 583 pazienti effettuata negli anni dal 1994 al 2012 (45), il tempo mediamente trascorso fra l’ultima somministrazione di un vaccino contemente come adiuvante particelle di ossi-idrossido di alluminio e l’effettuazione della biopsia era di 65 mesi.
Rispetto a tale rapporto iniziale, si è notato l’aumento d’insorgenza di fibromialgia dopo 36 mesi nel 2001, vale a dire poco dopo il picco di vaccinazione degli adulti francesi ed a 53 mesi nel 2003 (46).
È stato somministrato un numero medio di 5,3 dosi di vaccini contenenti il suddetto adiuvante durante i 10 anni precedenti alla biopsia per rilevare fibromialgia, corrispondenti principalmente alle vaccinazioni contro l’epatite B (89,7%), il tetano (42,2%) e l’epatite A (8,8%). In pratica, si considera la fibromialgia macrofagica insolitamente persistente quando il tempo trascorso dall’ultima vaccinazione alla rilevazione della patologia tramite biopsia supera i 18 mesi. È importante considerare questo punto nei bambini che ricevono iniezioni multiple di vaccini nel primo anno di vita, aumentando così il rischio di insorgenza di fibromialgia rilevata in seguito a biopsia nel muscolo quadricipite (sito utilizzato per l’inoculazione delle vaccinazioni pediatriche) in aggiunta a patologie muscolari ereditarie: tale rischio potenzialmente esiste negli adulti, nei quali è estremamente raro, nonostante l’intenso programma di immunizzazione di pazienti affetti da distrofia muscolare.
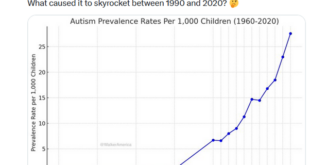
Studi effettuati sugli animali indicano che le lesioni granulomatose indotte dalle particelle di ossi-idrossido di alluminio variano notevolmente di dimensioni a seconda del background genetico (19), e l’ipotesi iniziale realizzata dall’OMS, cioè che la fibromialgia macrofagica può riflettere in qualche individuo l’incapacità di eliminare le particelle di ossi-idrossido di alluminio dal corpo, rimane valida (47): in sintesi, il perdurare nel tempo delle lesioni provocate dalla patologia dovrebbe esser considerata come un marker per valutare una persistenza biologica insolitamente protratta di particelle di ossi-idrossido di alluminio in individui affetti da fibromialgia macrofagica.
Encefalomielite mialgica / sindrome da fatica cronica per chi affetto da fibromialgia
La fibromialgia macrofagica (in inglese macrophagic myofasciitis o MMF) viene rilevata tipicamente in pazienti affetti da mialgie diffuse e stanchezzacronica, come mostrato nella serie di recente pubblicazione di 16 pazienti (48) ed in entrambe le precedenti serie francesi (46): in queste molti pazienti (70-80%) sono donne con un’età media di 45 anni al momento della biopsia, che in genere riportano mialgie, con o senza artralgia, ed un’invalidante stanchezza cronica […] La stanchezza cronica è un altro sintomo importante (48, 49): da uno studio caso-controllo condotto col patrocinio dell’agenzia di regolamentazione francese AFSSAPS è risultato che la stanchezza cronica è significativamente più frequente e più grave nei pazienti con fibromialgia rispetto a quelli senza fibromialgia nel muscolo deltoide (http://ansm.sante.fr/var/ansm_site/storage/original/application/030593fa4e393af7cec8ff7092832215.pdf).
... leggi tutto
Un ulteriore coinvolgimento del sistema nervoso è dato anche dalle alterazioni cognitive che sono invalidanti anche se spesso non rilevate da esami di routine, coloro che ne sono affetti riportano: perdita di memoria, sensazione di annebbiamento delle funzioni cognitive, cambiamenti di umore.
I test cognitivi mostrano quasi sempre alterazioni indicative di insufficienza cortico-sottocorticale organica, impatto sia sulla memoria visiva che su quella a breve termine (cioè quella parte di memoria che si occupa dell’elaborazione percettiva e linguistica consapevole immediata) ed infine ascolto dicotico (50). Questi deficit solitamente rimangono stabili nel tempo (51).
Nel loro insieme, il dolore muscolare cronico, la stanchezza cronica e la disfunzione cognitiva sono coerenti con la c.d. encefalomielite mialgica / sindrome da stanchezza cronica (in inglese myalgic encephalomyelitis/chronic fatigue syndrome o ME/CFS) e circa il 50% dei pazienti affetti da fibromialgia soddisfa i criteri internazionali di classificazione medica (48, 49) dell’encefalomielite mialgica, patologia grave, complessa, acquisita che è classificata dal WHO come disturbo neurologico dal 1969 (ICD 10 G93.3).
L’encefalomielite mialgica/sindrome da stanchezza cronica si distingue da fibromialgia e psicastenia, patologie queste che vengono classificate rispettivamente la prima come muscolo-scheletrica (M79.7) e la seconda come un disturbo psichiatrico (F48.8), seppure i sintomi siano molto simili a quelli della sindrome da stanchezza cronica (53): la causa scatenante dell’encefalomielite mialgica/sindrome da stanchezza cronica è attualmente ancora sconosciuta, ma si ritiene che la patologia venga innescata da una risposta immunitaria anomala ad un agente infettivo o tossico, che si traduce in un’attivazione immunitaria cronica (54), e chi ne è affetto corre anche il rischio di sviluppare linfomi diffusi a grandi cellule B e linfomi marginali a cellule B (55), altrimenti noti come linfomi non Hodgkin.
Studi internazionali hanno stimato la prevalenza di ME/CFS tra lo 0,4 ed il 2,6% della popolazione, con un’incidenza totale annua dei costi per la società di circa 18,7 – 24 miliardi di dollari solo negli USA (52): un tale onere per la sanità pubblica -sia statunitense che a livello globale- merita di certo sforzi continuativi per indagare sulle possibili cause e per comprenderne i meccanismi patogenici.
Diffusione dell’ossi-idrossido dai fagociti agli organi linfoidi ed infine al cervello
Il legame concettuale fra la persistenza a lungo termine di particelle di ossi-idrossido di alluminio all’interno dei macrofagi nel sito dell’inoculazione del vaccino ed il verificarsi di eventi avversi sistemici, in particolare quelli neurologici, è rimasto a lungo una quesito privo d’una risposta certa.
... leggi tutto
L’alluminio è stato a lungo identificato come un metallo neurotossico, che annovera i seguenti effetti:
- colpisce la memoria la cognizione ed il controllo psicomotorio,
- altera la neurotrasmissione e l’attività sinaptica,
- danneggia la barriera emato-encefalica (in inglese Blood-Brain Barrier o BBB),
- esercita effetti pro-ossidanti, attivando microglia e neuroinfiammazione,
- deprime il metabolismo del glucosio nel cervello e le funzioni mitocondriali,
- interferisce con attività trascrizionale, promozione di beta-amiloide, aggregazione di neurofilamenti (56).
Inoltre, le particelle di ossi-idrossido di alluminio influiscono sul sistema immunitario attraverso il loro effetto adiuvante, assorbendo gli antigeni sulla loro superficie, che li proteggono da proteolisi formando così un pseudo-patogeno persistentemente immunogenico (57). Le particelle di ossi-idrossido di alluminio possono anche legarsi con residui indesiderati di altri adiuvanti, sempre utilizzati nelle procedure per la sintesi di vaccini, come mostrato per le sequenze di DNA nel vaccino anti-papillomavirus HPV (58) o delle proteine dello lievito (59) che possono esser potenzialmente pericolosi (60). Ed infine, le particelle di ossi-idrossido di alluminio possono esse stesse indurre direttamente allergia (61, 62), così come altri metalli (63).
Le preoccupazioni legate alla persistenza biologica a lungo termine delle particelle di ossi-idrossido di alluminio dipendono in larga misura dalla loro capacità di raggiungere ed esercitare tossicità negli organi remoti, come suggerito da diversi studi (64 – 67) […]
Nel cervello, le particelle di ossi-idrossido di alluminio sono state trovate principalmente nelle cellule microgliali. In conformità con buona tolleranza generale di tali particelle, la penetrazione nel cervello era estremamente bassa in condizioni normali. Tuttavia, la traslocazione nel cervello risultava significativamente aumentata nel caso di alterata barriera emato-encefalica (in inglese blood-brain barrier o BBB) o dopo aumento sistemico e/o cerebrale dei segnali sia del monocita infiammatorio chemotattico MCP-1 (§) che del gene CCL2 (5). È stato identificato un aumento selettivo dei suddetti monocita infiammatorio e gene in pazienti affetti da encefalomielite mialgica/sindrome da stanchezza cronica e fibromialgia (45).
Lo squilibrio tra l’enorme numero di soggetti vaccinati ed il numero relativamente basso di casi di fibromialgia macrofagica suggerisce il coinvolgimento cruciale di fattori di suscettibilità individuale d’intolleranza alle particelle di ossi-idrossido di alluminio, di cui uno potrebbe essere rappresentato da una produzione geneticamente guidata di tali monocita infiammatorio e gene (5).
Sia le particelle di ossi-idrossido di alluminio che altri adiuvanti poco biodegradabili vengono catturati ed inglobati dai fagociti, entrando così nella circolazione sanguigna e linfatica e potendo quindi giungere nel cervello tramite un meccanismo come quello del cavallo di Troia descritto in precedenza per le particelle infettive (HIV, HCV) (68, 69). Esperimenti precedenti hanno dimostrato che l’inoculazione di particelle di ossi-idrossido di alluminio può causare disfunzioni del sistema nervoso centrale e danni (70 – 72), gettando dubbi sull’esatto livello di sicurezza di tale adiuvante (73).
Concetto di ASIA (Autoimmune/autoinflammatory Syndrome Induced by Adjuvants)
Molte malattie del sistema nervoso centrale probabilmente derivano da interazioni gene-ambiente. Alcune di loro, come la forma idiopatica di encefalomielite mialgica/sindrome da stanchezza cronica (in inglese Myalgic Encephalomyelitis/Chronic Fatigue Syndrome o ME/CFS) (74) e la sclerosi multipla o SM (in inglese Multiple Sclerosis o MS) (75), sono state precedentemente associate con sovraccarico di alluminio nell’organismo. Anche un aumentato rischio di sviluppare la sclerosi multipla in un lungo periodo dopo la somministrazione di vaccini contenenti ossi-idrossido di alluminio come adiuvante è stato segnalato (76, 77), e rimane oggetto di acceso dibattito.
... leggi tutto
In particolare, circa il 10% dei pazienti affetti da fibromialgia aveva un’altra patologia concomitante simile alla sclerosi multipla (78), un ulteriore 5-10% un’altra patologia autoimmune come la tiroidite e diffuse miopatie infiammatorie, ed i restanti pazienti a volte avevano bassi titoli di vari autoanticorpi (46).
Il ricercatore Prof. Dr. Yehuda Shoenfeld ha delineato la “sindrome autoimmune/autoinfiammatoria indotta da adiuvanti” (in inglese Autoimmune/Autoinflammatory Syndrome Induced by Adjuvants o ASIA) (79), riconoscendo che diverse combinazioni di (i) specifiche patologie autoimmuni individuate in base a criteri ben definiti, (ii) sintomi meno specifici, come ad esempio mialgia, artralgia, stanchezza cronica e deterioramento cognitivo -la cui combinazione insieme corrisponde ad encefalomielite mialgica / sindrome da stanchezza cronica e (iii) la comparsa di autoanticorpi circolanti, può verificarsi dopo esposizione ad una varietà di prodotti chimici o naturali con medesime proprietà immunologiche degli adiuvanti.
Le discussioni in merito alle patologie ASIA sono molto utili in quanto possono allertare i medici quando riscontrano i sintomi di cui sopra, al fine di controllare le vaccinazioni precedenti, e possono aiutarli ad associare un nome, una definizione a tali condizioni.
I sintomi associati con la fibromialgia macrofagica (in inglese macrophagic myofasciitis o MMF) sono sorprendentemente simili a quelli descritti come la sindrome della guerra del Golfo (in inglese Gulf War Syndrome o GWS), una condizione fortemente associata alla somministrazione di vaccinazioni multiple ai soldati (80, 81), in particolare del vaccino contro l’antrace che contiene ossi-idrossido di alluminio in grado di indurre fibromialgia (82), così come probabilmente lo squalene (83). Per tali ragioni è stata proposta la delineazione di una sindrome indotta da adiuvanti (84): Yehuda Shoenfeld ragionava in modo simile, egli ha semplicemente aggiunto alla lista delle patologie ASIA anche la sindrome della guerra del Golfo e la fibromialgia macrofagica in base alla propria esperienza sulla siliconosis (bit.ly/Siliconosis-pdf), una patologia complessa (osservata nelle pazienti con protesi di silicone al seno) che comporta il lento, costante e deleterio rilascio di particelle di silicone, dal comportamento simile a quello di altri composti utilizzati come adiuvanti (85, 86). Così facendo, ha ampliato la relazione causale con qualsiasi composto con proprietà adiuvanti.
Maggiori e minori criteri diagnostici delle patologie ASIA sono tuttora in attesa di una convalida internazionale, ma il concetto di ASIA ha già catturato l’attenzione della comunità medica internazionale per gli esseri umani e quella veterinaria, sottolineando la necessità in questo settore di ricerca (87, 88).
L’importanza di comprendere le ragioni per cui, in alcune persone, i vaccini contenenti particelle di ossi-idrossido di alluminio -usati come adiuvante- possono divenire insidiosamente pericolosi
L’ossi-idrossido di alluminio (corrispondente a solfato di alluminio e potassio dodecaidrato, con formula chimica KAl(SO4)2*12H2O è un composto cristallino ampiamente utilizzato da decenni (a livelli considerati di compromesso accettabile nonostante i suoi noti effetti neurotossici) come adiuvante nei vaccini. Tale compromesso pare essere accettato da parte delle compagnie di settore stesse (farmaceutiche) e dall’autorità pubblica, ossia dagli enti governativi. Tuttavia, l’esperienza e le storie cliniche legate alla fibromialgia hanno fatto emergere diverse lacune nella conoscenza delle particelle di ossi-idrossido di alluminio, comprese il loro esatto meccanismo d’azione, il loro ‘destino’ dopo l’inoculazione, la loro diffusione sistemica e la loro sicurezza sul lungo termine.
... leggi tutto
Nonostante siano stati fatti sforzi per sviluppare nuovi adiuvanti negli ultimi anni, alcun tentativo è stato ancora effettuato per esaminare seriamente i problemi di sicurezza sollevati dalla caratteristica saliente di tale adiuvante quale la sua traslocazione e persistenza biologica nel cervello È importante cercare i fattori di suscettibilità genetica che potrebbero spiegare le ragioni per cui un determinato individuo apparirà intollerante ai vaccini contenenti particelle di ossi-idrossido di alluminio, mentre la stragrande maggioranza di persone sottoposte a profilassi vaccinale con gli stessi vaccini rimane (apparentemente) in buona salute Le principali questioni che dovrebbero essere affrontate in materia di problemi di sicurezza per l’impiego come adiuvante delle particelle di ossi-idrossido di alluminio sono elencate qui (in inglese).
Come precedentemente accennato, l’ossi-idrossido di alluminio (corrispondente a solfato di alluminio e potassio dodecaidrato, con formula chimica KAl(SO4)2*12H2O) è un composto cristallino ampiamente utilizzato come adiuvante nei vaccini.
Le particelle di tale composto sono probabilmente tossiche per le membrane neuronali, e potrebbero:
- destabilizzare fagosomi e lisosomi
- attivare l’inflammasome NLRP3,
- rilasciare l’interleuchina 1B (nota anche come IL-1B)
- attivare il meccanismo infiammatorio nella sua totalità
- impedire i meccanismi dell’autofagocitosi (32-35, 39).
Tuttavia, l’assorbimento di particelle di ossi-idrossido di alluminio, piuttosto che indurne la morte, favorisce la sopravvivenza degli stessi macrofagi (17): il loro ‘comportamento’ viene modificato, venendo indotti dall’adiuvante ad inglobare continuamente particelle estranee nel loro citoplasma, come se si trattasse di organelli senescenti oppure batteri, ed a reiterare il processo autofagico sino a che dispongono di materiale estraneo. I cristalli di ossi-idrossido di alluminio si legano a doppio strato alla membrana plasmatica dei lipidi e l’aggrediscono (33), destabilizzando i lisosomi che degradano i materiali estranei tramite endocitosi, fagocitosi o autofagocitosi (34, 35). Le particelle all’interno della doppia membrana degli autofagosomi e la loro successiva fusione con i lisosomi ri-acidificati riparati espongono le particelle di ossi-idrossido di alluminio ad un pH lisosomiale acido, fattore unico questo che può renderle solubili…
[…]
La membrana esterna autofagosoma alla fine si fonde coi lisosomi: i geni di tutte le molecole facenti parte del meccanismo di autofagocitosi sono soggetti a modifiche strutturali attualmente constatabili nei pazienti affetti da fibromialgia macrofagica.
Ringraziamenti
Questo studio scientifico ha beneficiato di finanziamenti per la ricerca da parte delle associazioni di pazienti: E3M (Entraide aux Malades de Myofasciite à Macrophages) “Neurodélivrance des particules injectées par voie intra musculaire et sécurité des adjuvants aluminiques,” Association Française contre les Myopathies (AFM) “Etude des mécanismes de la myofasciite à macrophages,” and Dwoskin Foundation (Nanoparticelle presenti nel cervello); dalla regione francese dell’Ile-de-France tramite il programma PICRI (Partenariat Institutions-Citoyens pour la Recherche et l’Innovation) “Recherche de polymorphismes dans les gènes codant pour des facteurs inflammatoires (chimiokines) dans la myofasciite à macrophages” ed infine da ANSM, per procedura d’offerta fuori gara dello studio scientifico “Biopersistence and neuromigration of aluminic adjuvants of vaccines: genetic risk factors and experimental neurotoxicity”
Dichiarazione in merito al conflitto d’interesse
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
(Mini glossario aggiuntivo!)
**. Autofagia antibatterica: molti batteri patogeni si basano su un ciclo intracellulare per garantire la loro proliferazione in cellule infettate, attraverso la loro capacità di evitare/aggirare le vie difensive, in specifico quelle battericide dell’ospite.
***. Gene CCL2: è uno dei numerosi geni delle citochine raggruppati sul braccio lungo, o q-arm, del cromosoma 17. Il gene CCL2 ed il suo recettore hanno dimostrato d’essere indotti e coinvolti in varie malattie.
§. Monocita infiammatorio chemotattico MCP-1: le chemochine costituiscono una superfamiglia di citochine chemotattiche -proteine secrete coinvolte nei processi infiammatori e immunomodulantisuddivise in quattro famiglie sulla base del numero ed alla distanza dei residui di cisteina conservati nel dominio N-terminale, (o anche solo N-terminale, abbreviato come NTD) d’una proteina o d’un poliptetide, è l’estremità di una catena di amminoacidi che termina con un gruppo amminico. Le chemochine svolgono un ruolo importante nel reclutare selettivamente monociti, neutrofili e linfociti, così come nell’indurre chemotassi (fenomeno biologico consistente nella migrazione attiva di cellule verso concentrazioni crescenti di una sostanza chimica, o attrattore chemotattico, quale può esser ad esempio un nutriente) attraverso l’attivazione di reccettori accoppiati alle proteine G (o GPGR). Il monocita infiammatorio chemotattico (MCP-1) è una delle chemochine chiave ( bit.ly/Monocyte_chemoattractant_MCP-1) che regola migrazione ed infiltrazione di monociti/macrofagi.
Riferimenti
1. Moxon ER, Siegriest CA. The next decade of vaccines: societal and scientific challenges. Lancet (2011) 378:348–59. doi: 10.1016/S0140-6736(11)60407-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
2. Agmon-Levin N, Paz Z, Israeli E, Shoenfeld Y. Vaccines and autoimmunity. Nat Rev Rheumatol (2009) 5(11):648–52. doi:10.1038/nrrheum.2009.196
CrossRef Full Text | Google Scholar
3. Gherardi RK, Coquet M, Chérin P, Authier FJ, Laforêt P, Bélec L, et al. Macrophagic myofasciitis: an emerging entity. Lancet (1998) 352(9125):347–52. doi:10.1016/S0140-6736(98)02326-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
4. Gherardi RK, Coquet M, Cherin P, Belec L, Moretto P, Dreyfus PA, et al. Macrophagic myofasciitis lesions assess long-term persistence of vaccinederived aluminum hydroxide in muscle. Brain (2001) 124:1821–31. doi:10.1093/brain/124.9.1821
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
5. Khan Z, Combadiere C, Authier FJ, Itier V, Lux F, Exley C, et al. Slow CCL2-dependent translocation of biopersistent particles from muscle to brain. BMC Med (2013) 11:99. doi:10.1186/1741-7015-11-99
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
6. Glenny A, Pope C, Waddington H, Wallace U. Immunological notes. XVII. The antigenic value of toxoid precipitated by potassium alum. J Pathol Bacteriol (1926) 26:38–9.
Google Scholar
7. Lu F, Boutselis I, Borch RF, Hogenesch H. Control of antigen-binding to aluminum adjuvants and the immune response with a novel phosphonate linker. Vaccine (2013) 13:946–8. doi:10.1016/j.vaccine.2013.07.019
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
8. Lu F, Hogenesch H. Kinetics of the inflammatory response following intramuscular injection of aluminum adjuvant. Vaccine (2013) 31(37):3979–86. doi:10.1016/j.vaccine.2013.05.107
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
9. Brigitte M, Schilte C, Plonquet A, Baba-Amer Y, Henri A, Charlier C, et al. Muscle resident macrophages control the immune cell reaction in a mouse model of notexin-induced myoinjury. Arthritis Rheum (2010) 62:268–79. doi:10.1002/art.27183
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
10. Liao H, Franck E, Fréret M, Adriouch S, Baba-Amer Y, Authier FJ, et al. Myoinjury transiently activates muscle antigen-specific CD8+ T cells in lymph nodes in a mouse model. Arthritis Rheum (2012) 64(10):3441–51. doi:10.1002/art.34551
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
11. Kool M, Soullié T, van Nimwegen M, Willart MA, Muskens F, Jung S, et al. Alum adjuvant boosts adaptive immunity by inducing uric acid and activating inflammatory dendritic cells. J Exp Med (2008) 205:869–82. doi:10.1084/jem.20071087
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
12. Wang HB, Weller PF. Pivotal advance: eosinophils mediate early alum adjuvant-elicited B cell priming and IgM production. J Leukoc Biol (2008) 83:817–21. doi:10.1189/jlb.0607392
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
13. Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, et al. In vivo absorption of aluminum-containing vaccine adjuvants using 26Al. Vaccine (1997) 15:1314–8. doi:10.1016/S0264-410X(97)00041-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
14. Shi Y, HogenEsch H, Hem SL. Change in the degree of adsorption of proteins by aluminum-containing adjuvants following exposure to interstitial fluid: freshly prepared and aged model vaccines. Vaccine (2001) 20:80–5. doi:10.1016/S0264-410X(01)00313-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
15. Morefield GL, Sokolovska A, Jiang D, HogenEsch H, Robinson JP, Hem SL. Role of aluminum-containing adjuvants in antigen internalization by dendritic cells in vitro. Vaccine (2005) 23:1588–95. doi:10.1016/j.vaccine.2004.07.050
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
16. Ghimire TR, Benson RA, Garside P, Brewer JM. Alum increases antigen uptake, reduces antigen degradation and sustains antigen presentation by DCs in vitro. Immunol Lett (2012) 147(1–2):55–62. doi:10.1016/j.imlet.2012.06.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
17. Hamilton JA, Byrne R, Whitty G. Particulate adjuvants can induce macrophage survival, DNA synthesis, and a synergistic, proliferative response to GM-CSF and CSF-1. J Leukoc Biol (2000) 67:226–32.
Pubmed Abstract | Pubmed Full Text | Google Scholar
18. Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Aluminum assay and evaluation of the local reaction at several time points after intramuscular administration of aluminum containing vaccines in the Cynomolgus monkey. Vaccine (2005) 23:1359–67. doi:10.1016/j.vaccine.2004.09.012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
19. Authier FJ, Sauvat S, Christov C, Chariot P, Raisbeck G, Poron MF, et al. AlOH3-adjuvanted vaccine-induced macrophagic myofasciitis in rats is influenced by the genetic background. Neuromuscul Disord (2006) 16:347–52. doi:10.1016/j.nmd.2006.02.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
20. Hutchison S, Benson RA, Gibson VB, Pollock AH, Garside P, Brewer JM. Antigen depot is not required for alum adjuvanticity. FASEB J (2012) 26:1272–9. doi:10.1096/fj.11-184556
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
21. Exley C, Swarbrick L, Gherardi RK, Authier FJ. A role for the body burden of aluminum in vaccine-associated macrophagic myofasciitis and chronic fatigue syndrome. Med Hypotheses (2009) 72:135–9. doi:10.1016/j.mehy.2008.09.040
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
22. Exley C, Siesjo P, Eriksson H. The immunobiology of aluminum adjuvants: how do they really work? Trends Immunol (2010) 31:103–9. doi:10.1016/j.it.2009.12.009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
23. Ulanova M, Tarkowski A, Hahn-Zoric M, Hanson LA. The common vaccine adjuvant aluminum hydroxide up-regulates accessory properties of human monocytes via an interleukin-4-dependent mechanism. Infect Immun (2001) 69:1151–9. doi:10.1128/IAI.69.2.1151-1159.2001
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
24. McKee AS, Munks MW, MacLeod MK, Fleenor CJ, Van Rooijen N, Kappler JW, et al. Alum induces innate immune responses through macrophage and mast cell sensors, but these sensors are not required for alum to act as an adjuvant for specific immunity. J Immunol (2009) 183:4403–14. doi:10.4049/jimmunol.0900164
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
25. Eisenbarth SC, Colegio OR, O’Connor W, Sutterwala FS, Flavell RA. Crucial role for the Nalp3 inflammasome in the immunostimulatory properties of aluminum adjuvants. Nature (2008) 453:1122–6. doi:10.1038/nature06939
CrossRef Full Text | Google Scholar
26. Li H, Willingham SB, Ting JP, Re F. Cutting edge. Inflammasome activation by alum and alum’s adjuvant effect are mediated by NLRP3. J Immunol (2008) 181:17–21. doi:10.1111/j.1365-2567.2007.02774.x
CrossRef Full Text | Google Scholar
27. Franchi L, Nunez G. The Nlrp3 inflammasome is critical for aluminum hydroxide-mediated IL-1beta secretion but dispensable for adjuvant activity. Eur J Immunol (2008) 38:2085–9. doi:10.1002/eji.200838549
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
28. Spreafico R, Ricciardi-Castagnoli P, Mortellaro A. The controversial relationship between NLRP3, alum, danger signals and the next generation adjuvants. Eur J Immunol (2010) 40:638–42. doi:10.1002/eji.200940039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
29. Kool M, Petrilli V, De Smedt T, Rolaz A, Hammad H, van Nimwegen M, et al. Cutting edge: alum adjuvant stimulates inflammatory dendritic cells through activation of the NALP3 inflammasome. J Immunol (2008) 181:3755–9. doi:10.4049/jimmunol.181.6.3755
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
30. Marichal T, Ohata K, Bedoret D, Mesnil C, Sabatel C, Kobiyama K, et al. DNA released from dying host cells mediates aluminum adjuvant activity. Nat Med (2011) 17:996–1002. doi:10.1038/nm.2403
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
31. Kuroda E, Ishii KJ, Uematsu S, Ohata K, Coban C, Akira S, et al. Silica crystals and aluminum salts regulate the production of prostaglandin in macrophages via NALP3 inflammasome-independent mechanisms. Immunity (2011) 34(4):514–26. doi:10.1016/j.immuni.2011.03.019
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
32. Shi Y. To forge a solid immune recognition. Protein Cell (2012) 3:564–70. doi:10.1007/s13238-012-2933-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
33. Flach TL, Ng G, Hari A, Desrosiers MD, Zhang P, Ward SM, et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nat Med (2011) 17:479–87. doi:10.1038/nm.2306
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
34. Hornung V, Bauernfeind F, Halle A, Samstad EO, Kono H, Rock KL, et al. Silica crystals and aluminum salts activate the NALP3 inflammasome through phagosomal destabilization. Nat Immunol (2008) 9:847–56. doi:10.1038/ni.1631
CrossRef Full Text | Google Scholar
35. Lima H Jr, Jacobson LS, Goldberg MF, Chandran K, Diaz-Griffero F, Lisanti MP, et al. Role of lysosome rupture in controlling Nlrp3 signaling and necrotic cell death. Cell Cycle (2013) 12(12):1868–78. doi:10.4161/cc.24903
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
36. Trombetta ES, Ebersold M, Garrett W, Pypaert M, Mellman I. Activation of lysosomal function during dendritic cell maturation. Science (2003) 299:1400–3. doi:10.1126/science.1080106
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
37. Delamarre L, Couture R, Mellman I, Trombetta ES. Enhancing immunogenicity by limiting susceptibility to lysosomal proteolysis. J Exp Med (2006) 203:2049–55. doi:10.1084/jem.20052442
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
38. Shin JS, Ebersold M, Pypaert M, Delamarre L, Hartley A, Mellman I. Surface expression of MHC class II in dendritic cells is controlled by regulated ubiquitination. Nature (2006) 444:115–8. doi:10.1038/nature05261
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
39. Kang SJ, Locksley RM. The inflammasome and alum-mediated adjuvanticity. F1000 Biol Rep (2009) 1:15. doi:10.3410/B1-15
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
40. Bassez G, Authier FJ, Lechapt-Zalcman E, Delfau-Larue MH, Plonquet A, Coquet M, et al. Inflammatory myopathy with abundant macrophages (IMAM): a condition distinct from macrophagic myofasciitis, sharing similarities with cytophagic histiocytic panniculitis. J Neuropathol Exp Neurol (2003) 62:464–74.
Pubmed Abstract | Pubmed Full Text | Google Scholar
41. Maubec E, Pinquier L, Viguier M, Caux F, Amsler E, Aractingi S, et al. Vaccination-induced cutaneous pseudolymphoma. J Am Acad Dermatol (2005) 52(4):623–9. doi:10.1016/j.jaad.2004.12.021
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
42. Madewell BR, Griffey SM, McEntee MC, Leppert VJ, Munn RJ. Feline vaccine-associated fibrosarcoma: an ultrastructural study of 20 tumors (1996-1999). Vet Pathol (2001) 38(2):196–202. doi:10.1354/vp.38-2-196
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
43. Ragunathan-Thangarajah N, Le Beller C, Boutouyrie P, Bassez G, Laurent S, Authier FJ. Distinctive clinical features in arthromyalgic patients with and without aluminum hydroxide-induced macrophagic myofasciitis: an exploratory study. J Inorg Biochem (2013) 128:262–6. doi:10.1016/j.jinorgbio.2013.07.020
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
44. Papo T. Macrophagic myofasciitis: focal or systemic? Joint Bone Spine (2003) 70:242–5. doi:10.1016/S1297-319X(03)00093-9
CrossRef Full Text | Google Scholar
45. Cadusseau J, Ragunathan-Thangarajah N, Surenaud M, Hue S, Authier FJ, Gherardi RK. Selective elevation of circulating CCL2/MCP1 levels in patients with longstanding post-vaccinal macrophagic myofasciitis and ASIA. Curr Med Chem (2014) 21:511–7. doi:10.2174/09298673113206660287
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
46. Gherardi RK, Authier FJ. Aluminum inclusion macrophagic myofasciitis: a recently identified condition. Immunol Allergy Clin North Am (2003) 23:699–712. doi:10.1016/S0889-8561(03)00095-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
47. World Health Organization Vaccine Safety Advisory Committee. Macrophagic myofasciitis and aluminum-containing vaccines. Wkly Epidemiol Rec (1999) 74:338–40.
Google Scholar
48. Santiago T, Rebelo O, Negrão L, Matos A. Macrophagic myofasciitis and vaccination: consequence or coincidence? Rheumatol Int (2015) 35(1):189–92. doi:10.1007/s00296-014-3065-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
49. Authier FJ, Sauvat S, Champey J, Drogou I, Coquet M, Gherardi R. Chronic fatigue syndrome in patients with macrophagic myofasciitis. Arthritis Rheum (2003) 48:569–70. doi:10.1002/art.10740
CrossRef Full Text | Google Scholar
50. Couette M, Boisse MF, Maison P, Brugieres P, Cesaro P, Chevalier X, et al. Long-term persistence of vaccine-derived aluminum hydroxide is associated with chronic cognitive dysfunction. J Inorg Biochem (2009) 103:1571–8. doi:10.1016/j.jinorgbio.2009.08.005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
51. Passeri E, Villa C, Couette M, Itti E, Brugieres P, Cesaro P, et al. Long-term follow-up of cognitive dysfunction in patients with aluminum hydroxide-induced macrophagic myofasciitis (MMF). J Inorg Biochem (2011) 105:1457–63. doi:10.1016/j.jinorgbio.2011.08.006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
52. Jason A, Benton C, Valentine L, Johnson A, Torres-Harding S. The economic impact of ME/CFS: individual and societal costs. Dyn Med (2007) 7:6. doi:10.1186/1476-5918-7-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
53. Hickie I, Davenport T, Wakefield D, Vollmer-Conna U, Cameron B, Vernon SD, et al. Post-infective and chronic fatigue syndromes precipitated by viral and non-viral pathogens: prospective cohort study. BMJ (2006) 333(7568):575. doi:10.1136/bmj.38933.585764.AE
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
54. Landay AL, Jessop C, Lennette ET, Levy JA. Chronic fatigue syndrome: clinical condition associated with immune activation. Lancet (1991) 338:707–12. doi:10.1016/0140-6736(91)91440-6
CrossRef Full Text | Google Scholar
55. Chang CM, Warren JL, Engels EA. Chronic fatigue syndrome and subsequent risk of cancer among elderly US adults. Cancer (2012) 118(23):5929–36. doi:10.1002/cncr.27612
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
56. Tomljenovic L. Aluminum and Alzheimer’s disease: after a century of controversy, is there a plausible link? J Alzheimer Dis (2011) 23:567–98. doi:10.3233/JAD-2010-101494
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
57. Rosenblum H, Shoenfeld Y, Amital H. The common immunogenic etiology of chronic fatigue syndrome: from infections to vaccines via adjuvants to the ASIA syndrome. Infect Dis Clin North Am (2011) 25(4):851–63. doi:10.1016/j.idc.2011.07.012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
58. Lee SH. Detection of human papillomavirus (HPV) L1 gene DNA possibly bound to particulate aluminum adjuvant in the HPV vaccine Gardasil. J Inorg Biochem (2012) 117:85–92. doi:10.1016/j.jinorgbio.2012.08.015
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
59. Offit PA, Jew RK. Addressing parents’ concerns: do vaccines contain harmful preservatives, adjuvants, additives, or residuals? Pediatrics (2003) 112(6):1394–7. doi:10.1542/peds.112.6.1394
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
60. Rinaldi M, Perricone R, Blank M, Perricone C, Shoenfeld Y. Anti-Saccharomyces cerevisiae autoantibodies in autoimmune diseases: from bread baking to autoimmunity. Clin Rev Allergy Immunol (2013) 45(2):152–61. doi:10.1007/s12016-012-8344-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
61. Lopez S, Pelaez A, Navarro LA, Montesinos E, Morales C, Carda C. Aluminum allergy in patients hyposensitized with aluminum-precipitated antigen extracts. Contact Dermatitis (1994) 31:37–40. doi:10.1111/j.1600-0536.1994.tb01903.x
CrossRef Full Text | Google Scholar
62. Bergfors E, Björkelund C, Trollfors B. Nineteen cases of persistent pruritic nodules and contact allergy to aluminum after injection of commonly used aluminum-adsorbed vaccines. Eur J Pediatr (2005) 164(11):691–7. doi:10.1007/s00431-005-1704-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
63. Falta MT, Pinilla C, Mack DG, Tinega AN, Crawford F, Giulianotti M, et al. Identification of beryllium-dependent peptides recognized by CD4+ T cells in chronic beryllium disease. J Exp Med (2013) 210(7):1403–18. doi:10.1084/jem.20122426
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
64. Wen GY, Wisniewski HM. Histochemical localization of aluminum in the rabbit CNS. Acta Neuropathol (1985) 68:175–84. doi:10.1007/BF00690191
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
65. Redhead K, Quinlan GJ, Das RG, Gutteridge JM. Aluminum-adjuvanted vaccines transiently increase aluminum levels in murine brain tissue. Pharmacol Toxicol (1992) 70:278–80. doi:10.1111/j.1600-0773.1992.tb00471.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
66. Sahin G, Varol I, Temizer A, Benli K, Demirdamar R, Duru S. Determination of aluminum levels in the kidney, liver, and brain of mice treated with aluminum hydroxide. Biol Trace Elem Res (1994) 41:129–35. doi:10.1007/BF02917223
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
67. Wang XY, Yao X, Wan YM, Wang B, Xu JQ, Wen YM. Responses to multiple injections with alum alone compared to injections with alum adsorbed to proteins in mice. Immunol Lett (2012) 149:88–92. doi:10.1016/j.imlet.2012.11.005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
68. Drevets DA, Dillon MJ, Schawang JS, Van Rooijen N, Ehrchen J, Sunderkotter C, et al. The Ly-6Chigh monocyte subpopulation transports Listeria monocytogenes into the brain during systemic infection of mice. J Immunol (2004) 172:4418–24. doi:10.4049/jimmunol.172.7.4418
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
69. Eugenin EA, Osiecki K, Lopez L, Goldstein H, Calderon TM, Berman JW. CCL2/monocyte chemoattractant protein-1 mediates enhanced transmigration of human immunodeficiency virus (HIV)-infected leukocytes across the blood-brain barrier: a potential mechanism of HIV-CNS invasion and NeuroAIDS. J Neurosci (2006) 26:1098–106. doi:10.1523/JNEUROSCI.3863-05.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
70. Petrik MS, Wong MC, Tabata RC, Garry RF, Shaw CA. Aluminum adjuvant linked to Gulf war illness induces motor neuron death in mice. Neuromolecular Med (2007) 9(1):83–100. doi:10.1385/NMM:9:1:83
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
71. Shaw CA, Petrik MSJ. Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration. J Inorg Biochem (2009) 103:1555–62. doi:10.1016/j.jinorgbio.2009.05.019
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
72. Shaw CA, Li Y, Tomljenovic L. Administration of aluminum to neonatal mice in vaccine-relevant amounts is associated with adverse long term neurological outcomes. J Inorg Biochem (2013) 128:237–44. doi:10.1016/j.jinorgbio.2013.07.022
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
73. Tomljenovic L, Shaw CA. Aluminum vaccine adjuvants: are they safe? Curr Med Chem (2011) 18:2630–7. doi:10.2174/092986711795933740
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
74. van Rensburg SJ, Potocnik FC, Kiss T, Hugo F, van Zijl P, Mansvelt E, et al. Serum concentrations of some metals and steroids in patients with chronic fatigue syndrome with reference to neurological and cognitive abnormalities. Brain Res Bull (2001) 55(2):319–25. doi:10.1016/S0361-9230(01)00478-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
75. Exley C, Mamutse G, Korchazhkina O, Pye E, Strekopytov S, Polwart A, et al. Elevated urinary excretion of aluminum and iron in multiple sclerosis. Mult Scler (2006) 12(5):533–40. doi:10.1177/1352458506071323
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
76. Hernán MA, Jick SS, Olek MJ, Jick H. Recombinant hepatitis B vaccine and the risk of multiple sclerosis: a prospective study. Neurology (2004) 63(5):838–42. doi:10.1212/01.WNL.0000138433.61870.82
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
77. Mikaeloff Y, Caridade G, Suissa S, Tardieu M. Hepatitis B vaccine and the risk of CNS inflammatory demyelination in childhood. Neurology (2009) 72(10):873–80. doi:10.1212/01.wnl.0000335762.42177.07
CrossRef Full Text | Google Scholar
78. Authier FJ, Cherin P, Creange A, Bonnotte B, Ferrer X, Abdelmoumni A, et al. Central nervous system disease in patients with macrophagic myofasciitis. Brain (2001) 124(5):974–83. doi:10.1093/brain/124.5.974
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
79. Shoenfeld Y, Agmon-Levin N. ‘ASIA’ – autoimmune/inflammatory syndrome induced by adjuvants. J Autoimmun (2011) 36(1):4–8. doi:10.1016/j.jaut.2010.07.003
CrossRef Full Text | Google Scholar
80. Hotopf M, David A, Hull L, Ismail K, Unwin C, Wessely S. Role of vaccinations as risk factors for ill health in veterans of the Gulf war: cross sectional study. BMJ (2000) 320:1363–7. doi:10.1136/bmj.320.7246.1363
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
81. Cherry N, Creed F, Silman A, Dunn G, Baxter D, Smedley J, et al. Health and exposures of United Kingdom Gulf war veterans. Part II: the relation of health to exposure. Occup Environ Med (2001) 58:299–306. doi:10.1136/oem.58.5.299
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
82. Theeler BJ, Simper NB, Ney JP. Polyglandular autoimmunity with macrophagic myofasciitis. Clin Rheumatol (2008) 27(5):667–9. doi:10.1007/s10067-007-0793-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
83. Asa PB, Cao Y, Garry RF. Antibodies to squalene in Gulf war syndrome. Exp Mol Pathol (2000) 68(1):55–64. doi:10.1006/exmp.1999.2295
CrossRef Full Text | Google Scholar
84. Gherardi RK. Lessons from macrophagic myofasciitis: towards definition of a vaccine adjuvant-related syndrome. Rev Neurol (Paris) (2003) 159(2):162–4.
Pubmed Abstract | Pubmed Full Text | Google Scholar
85. Miyoshi K, Miyamura T, Kobayashi Y, Itakura T, Nishijo K. Hypergammaglobulinemia by prolonged adjuvanticity in man disorders developed after augmentation mammoplasty. Jpn Med J (1964) 2122:9–14.
Google Scholar
86. Shoaib BO, Patten BM. Human adjuvant disease: presentation as a 414 multiple sclerosis-like syndrome. South Med J (1996) 89:179–88. doi:10.1097/00007611-199602000-00005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
87. Luján L, Pérez M, Salazar E, Álvarez N, Gimeno M, Pinczowski P, et al. Autoimmune/autoinflammatory syndrome induced by adjuvants (ASIA syndrome) in commercial sheep. Immunol Res (2013) 56(2–3):317–24. doi:10.1007/s12026-013-8404-0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
88. Vasey FB, Zarabadi SA, Seleznick M, Ricca L. Where there’s smoke there’s fire: the silicone breast implant controversy continues to flicker: a new disease that needs to be defined. J Rheumatol (2003) 30(10):2092–4.
Google Scholar
89. Guis S, Pellissier JF, Nicoli F, Reviron D, Mattei JP, Gherardi RK, et al. HLA-DRB1*01 and macrophagic myofasciitis. Arthritis Rheum (2002) 46:2535–7. doi:10.1002/art.10465
CrossRef Full Text | Google Scholar
90. Nyquist P, Zhang J, De Graba TJ. The -928 G/C and -362 G/C single-nucleotide polymorphisms in the promoter of MCP1: increased transcriptional activity and novel binding sites. Cerebrovasc Dis (2010) 29:242–7. doi:10.1159/000267849
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
91. Sridhar S, Botbol Y, Macian F, Cuervo AM. Autophagy and disease: always two sides to a problem. J Pathol (2012) 226:255–73. doi:10.1002/path.3025
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
92. Brest P, Lapaquette P, Souidi M, Lebrigand K, Cesaro A, Vouret-Craviari V, et al. A synonymous variant in IRGM alters a binding site for miR-196 and causes deregulation of IRGM-dependent xenophagy in Crohn’s disease. Nat Genet (2011) 43(3):242–5. doi:10.1038/ng.762
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
93. Stern ST, Adiseshaiah PP, Crist RM. Autophagy and lysosomal dysfunction as emerging mechanisms of nanomaterial toxicity. Part Fibre Toxicol (2012) 9:20. doi:10.1186/1743-8977-9-20
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
94. Zheng YT, Shahnazari S, Brech A, Lamark T, Johansen T, Brumell JH. The adaptor protein p62/SQSTM1 targets invading bacteria to the autophagy pathway. J Immunol (2009) 183(9):5909–16. doi:10.4049/jimmunol.0900441
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
95. Lee HS, Daniels BH, Salas E, Bollen AW, Debnath J, Maregeta M. Clinical utility of LC3 and p62 immunohistochemistry in diagnosis of drug-induced autophagic vacuolar myopathies: a case-control study. PLoS One (2012) 7(4):e36221. doi:10.1371/journal.pone.0036221
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
 quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere
quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere