Approfondimento sulla difterite, le cui informazioni generiche sono su epicentro.iss.it :
l’agente patogeno è il batterio Corynebacterium diphtheriae, del quale sono conosciute 4 varietà (var): mitis, intermedius, gravis ed infine belfanti, cui corrispondono almeno di 57 sierotipi ed almeno 19 tipi fagici.
Tale batterio da solo è privo di pericolosità! Difatti, affinché divenga infettante, è necessaria l’interazione di uno specifico virus batteriofago responsabile della trasformazione lisogenica:
• solo in questo caso è in grado di secernere la tossina difterica, che è poi la causa delle complicanze della difterite,
• solo i cosiddetti ceppi tossigeni sono patogeni per l’uomo, mentre gli altri possono essere ospiti abituali della gola.
Attenzione: il batteriofago di un qualsiasi ceppo tossigeno può passare ad altri ceppi batterici inizialmente non tossigenici -normalmente presenti nell’apparato respiratorio- che diverrebbero così tossinogenici e possibili fonti di contagio.
La tossina prodotta (identica per tutti le 4 principali varietà e nei 57 sierotipi di Corynebacterium diphtheriae) si diffonde attraverso il flusso ematico ed i suoi effetti avvengono sia localmente (interessando le prime vie respiratorie, formandovi placche e membrane che riducendo lo spazio per il passaggio dell’aria rendono difficoltosa la respirazione), sia a distanza dalla zona di infezione (soprattutto a livello cardiaco e sul sistema nervoso).
Gli organi coinvolti localmente variano a seconda del sierotipo di batterio: il più diffuso colpisce gola, naso e talvolta le tonsille.
La tossina proteica è costituita da due frammenti di cui il frammento B è responsabile dell’adesione ai recettori cellulari, mentre il frammento A è responsabile dell’azione tossica, per mezzo di una reazione enzimatica che inibisce la sintesi proteica con conseguente morte cellulare.
Quando e se la vaccinazione conferisce immunità (vedesi i non-responder al vaccino), essa protegge dai soli effetti della tossina lasciando in realtà circolante il batterio, che nei vaccinati può sia portare ad una forma blanda di infezione che (*) rimanere latente, attivo e contagioso verso i non vaccinati e gli immunocompromessi sino a sei mesi!! Quando in un soggetto vaccinato viene rinvenuto il batterio viene somministrato l’antibiotico al fine di uccidere l’agente patogeno ed evitare che possa così esser trasmettesso ad altri.
(*) – Fonte: Ministero della Salute spagnola.
Tale patologia riguarda:
- essenzialmente bambini non vaccinati sino ad 1 anno di età,
- gli adulti non vaccinati,
- i viaggiatori non vaccinati che stanno per recarsi in zone endemiche.
Nei Paesi con clima temperato si diffonde durante i mesi invernali, trasmettendosi per contatto diretto con una
persona infetta o, più raramente, con oggetti contaminati da secrezioni delle lesioni di un paziente.
Incubazione del batterio Corynebacterium diphtheriae
L’incubazione dura dai due (2) ai cinque (5) giorni.
Quando l’infezione riguarda l’apparato orofaringeo, i primi sintomi sono mal di gola, perdita dell’appetito e febbre leggera: entro due o tre (2/3) giorni, sulla superficie delle tonsille e della gola si forma una caratteristica membrana grigiastra, dai margini infiammati, che può anche sanguinare e assumere un colore verdastro o nero. Altri sintomi associati all’infezione possono essere gonfiore del collo e ostruzione delle vie respiratorie. Generalmente la difterite ha un “decorso benigno”. Chi sviluppa la patologia viene trattato immediatamente con antitossina (se necessario) ed antibiotici (eritromicina o penicillina), quindi viene messo in isolamento per evitare che contagi altre persone. In genere, già dopo due giorni di terapia non si è più contagiosi.
Durata dell’immunità da vaccinazione
L’immunità diminuisce nel corso del tempo e si dovrebbe ripetere un richiamo del vaccino —> ogni 10 anni
Condivido il link bit.ly/Diphtheria-in-India (IMHO interessantissimo studio scientifico)
In the last 10 years, there have been a number of reports of either re-emergence or persistence of diphtheria from several Indian states, without much decline over the —>last 25 years. The disease, which was common among under- five children in the past, is now affecting older children (5–19 years) and adults. The majority of the cases are reported from children who were ***un-immunized/partially immunized*** against diphtheria […] immunity acquired through primary immunization wanes in early childhood.
Negli ultimi 10 anni c’è stata una serie di segnalazioni delle relazioni inerenti il riemergere o il persistere della difterite, senza un grande calo nel corso degli ultimi 25 anni. La patologia, che era comune tra i bambini sotto i cinque anni in passato, sta colpendo bambini più grandi ( 5-19 anni) ed adulti. La maggior parte dei casi segnalati sono di bambini che erano ***non- immunizzati / parzialmente immunizzati*** contro la difterite [ … ] l’immunità acquisita tramite l’immunizzazione primaria diminuisce nella prima infanzia.
Effect of cellular iron concentration on iron uptake by hepatocytes
Ruolo del ferro nell’insorgenza della patologia
Abstract
The effect of intracellular iron content on transferrin and iron uptake by cultured hepatocytes isolated from fetal rat liver was examined with ferric ammonium citrate and the iron chelator desferrioxamine (DFO). Incubation of the cells with ferric ammonium citrate for 24 h significantly increased the cellular nonheme iron level, whereas the number of transferrin binding sites and the uptake of transferrin and iron were reduced. In contrast, when iron-treated cells were incubated with DFO for 24 h, the cellular nonheme iron level was not altered, but the number of transferrin binding sites was increased. Treatment of the cells with exogenous iron and/or DFO did not affect the uptake of transferrin and iron by the nonsaturable processes. These results indicated that, in cultured hepatocytes, transferrin receptor expression and the subsequent uptake of transferrin and iron are regulated by the size of an intracellular, chelatable iron pool, whereas the uptake of iron by the nonsaturable processes is dependent on the extracellular transferrin concentration
Riassunto
E’ stato esaminato l’effetto del contenuto di ferro intracellulare su transferrina e l’assorbimento del ferro da parte delle culture di epatociti estratte dal fegato del feto di ratto con citrato ammonico ferrico e la deferoxamina, un chelante del ferro (DFO). L’incubazione delle cellule con citrato ammonico ferrico per 24 ore ha aumentato significativamente il livello di ferro non-eme cellulare, mentre il numero di siti di legame della transferrina ed il suo assorbimento insieme al ferro sono stati ridotti. Al contrario, quando le cellule di ferro trattate sono state incubate con DFO per 24 h, il livello di ferro non-eme cellulare non è stato modificato, ma il numero di siti di legame della transferrina è aumentato. Il trattamento delle cellule con il ferro esogeno e/o DFO è quindi stato ininfluente sulla diffusione di transferrina e ferro dipendente da processi non saturabili . Questi risultati indicano che, in culture di epatociti, l’espressione del recettore della transferrina ed il successivo assorbimento di transferrina e ferro sono regolati dalle dimensioni di un pool di ferro chelabile intracellulare, mentre l’assorbimento di ferro dipendente da processi non saturabili è legato alla concentrazione di trasferrina extracellulare.
Biology and Molecular Epidemiology of Diphtheria Toxin and the tox Gene
Biologia e Epidemiologia molecolare della tossina difterica e il Gene tossico
Diphtheria toxin (DT) is an extracellular protein of Corynebacterium diphtheriae that inhibits protein synthesis and kills susceptible cells. The gene that encodes DT (tox) is present in some corynephages, and DT is only produced by C. Diphtheriae isolates that harbor tox+ phages. The diphtheria toxin repressor (DtxR) is a global regulatory protein that uses Fe2++ as co-repressor.
La tossina difterica (DT) è una proteina extracellulare del batterio Corynebacterium diphtheriae che inibisce la sintesi proteica ed uccide le cellule sensibili. Il gene codificante DT (tox) è presente in alcuni corynephages, ed esso è prodotto solo da C. Diphtheriae (dopo l’interazione d’uno specifico virus batteriofago responsabile della trasformazione lisogenica). Il repressore della tossina difterica (DtxR) è una proteina globale regolatrice che utilizza Fe2++ come co-repressore.
Un’ulteriore conferma di questo meccanismo lo si trova nel seguente approfondimento: Corynebacterium (pag. 10). La produzione della tossina difterica è inversamente proporzionale alla concentrazione di ferro nel mezzo di coltura. Ciò è dovuto al fatto che la regolazione dell’espressione del gene tox è mediata da un repressore attivato dal ferro, DtxR, che è codificato nel genoma di C diphtheriae. L’espressione di tox dipende dallo stato fisiologico di C. diphtheriae. In condizioni in cui il ferro rappresenta il substrato limitante, esso si dissocia da DtxR, il gene tox viene derepresso, e la tossina è sintetizzata e rilasciata nel terreno di cultura
Effects of Iron Deficiency on C. Diphtheriae
Effetti della carenza di ferro su C. Diphtheriae
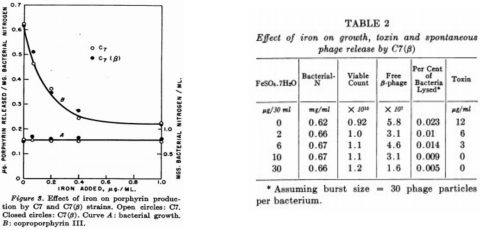
It is known that there is a relationship between toxin production and liberation of coproporphyrin III (Gray and Holt, 1948) by toxigenic strains of the diphtheria bacillus and that yields of both of these substances are in turn dependent upon a diminishing bacterial iron content (Pappenheimer, 1947, 1955). Cultural methods. Mitsuhashi et al. (1949) studied the kinetics of toxin production in shake cultures and showed that toxin is only liberated from cells during the declining growth phase. Thus, if small inocula are used, a considerable length of time will elapse before measurable amounts of toxin will be released. The extent of this lag period will depend on the size of inoculum, the growth rate and the iron content of the medium. In order to obtain toxin with a minimum of delay, therefore, the following method was devised and found to be satisfactory. Liberation of porphyrin by C7 and C7(#3) strains in relation to iron content of medium: as is shown in figure 3, with increasing concentrations of iron, porphyrin released into the culture supernatants decreased equally for both strains.
È noto che esiste una relazione fra la produzione della tossina e la liberazione di coproporfirine III (Gray e Holt, 1948) di ceppi tossigenici del bacillo della difterite e che le rese di entrambe queste sostanze son a loro volta dipendenti da una diminuzione del contenuto di ferro (Pappenheimer 1947, 1955). Metodi di coltura. Mitsuhashi et al. (1949) hanno studiato la cinetica di produzione delle tossine nelle culture in centrifuga ed hanno dimostrato che la tossina è liberata dalle cellule solo durante la fase di declino della crescita. Così, se si utilizzano piccoli inoculi, trascorrerà un considerevole periodo di tempo prima che quantità misurabili di tossina vengano liberate. L’estensione di questo periodo di latenza dipende dalla dimensione dell’inoculo, dal tasso di crescita e dal contenuto di ferro. Per ottenere la tossina con un minimo di ritardo, pertanto, è stato ideato tale metodo che si è rivelato soddisfacente Rilascio della porfirina dai ceppi C7 e C7 (# 3) in relazione al contenuto di ferro in media: come mostrato nella figura 3, con concentrazioni crescenti di ferro, la porfirina rilasciata è diminuita ugualmente per entrambi i ceppi.
Corynebacterium diphtheriae and Diphtheria
Corynebacterium diphtheriae e Difterite
The role of iron. In artificial culture the most important factor controlling yield of the toxin is the concentration of inorganic iron (Fe2++ or Fe3+++) present in the culture medium. Toxin is synthesized in high yield only after the exogenous supply of iron has become exhausted. (This has practical importance for the industrial production of toxin to make toxoid. Under the appropriate conditions of iron starvation, C. diphtheriae will synthesize diphtheria toxin as 5% of its total protein). Presumably, this phenomenon takes place in vivo as well. The bacterium may not produce maximal amounts of toxin until the iron supply in tissues of the upper respiratory tract has become depleted. It is the regulation of toxin production in the bacterium that is partially controlled by iron. The tox gene is regulated by a mechanism of negative control wherein a repressor molecule, product of the DtxR gene, is activated by iron. The active repressor binds to the tox gene operator and prevents transcription. When iron is removed from the repressor (under growth conditions of iron limitation), derepression occurs, the repressor is inactivated and transcription of the tox genes can occur. Iron is referred to as a corepressor since it is required for repression of the toxin gene.
Il ruolo del ferro. Nella coltura artificiale il più importante fattore di controllo di rendimento della tossina è la concentrazione di ferro inorganico (Fe2++ o Fe3+++) presente nel terreno di coltura. La tossina viene sintetizzata con alta resa solo dopo che l’apporto esogeno di ferro è divenuto esausto. (Ciò ha importanza pratica per la produzione industriale di tossina per ottenere il tossoide. Nelle condizioni appropriate di inedia di ferro, C. diphtheriae sintetizzerà la tossina difterica nel 5% della proteina totale). Presumibilmente, questo fenomeno si verifica anche in vivo. Il batterio potrebbe non produrre quantità massime di tossina fino a che la quantità di ferro nei tessuti del tratto respiratorio superiore s’impoverisce. È la regolazione della produzione di tossine del batterio che è parzialmente controllata da ferro. Il gene tox è regolata da un meccanismo di controllo negativo in cui una molecola di repressore, prodotto del gene DtxR, viene attivata dal ferro. Il repressore attivo si lega al gene tox e previene la trascrizione. Quando il ferro viene rimosso dal repressore (in condizioni di crescita con limitazione di ferro), si verifica de-repressione: il repressore è inattivato e trascrizione dei geni tossicologici può verificarsi. Il ferro è indicato come co-repressore poiché è necessario per la repressione del gene della tossina.
Solo una piccola parte del ferro alimentare viene assorbita dall’intestino: fitati, ftalati e fosfati presenti negli alimenti complessano il Fe3+++ ritardando o evitando il suo assorbimento. L’assorbimento ha luogo principalmente nel duodeno e nel digiuno. La forma presente negli alimenti è quella ossidata (Fe3+++), quella assorbita e quella ridotta (Fe2++). Nel lume intestinale la ferro-reduttasi riduce, dunque, il ferro permettendo il suo trasporto dal lume nella cellula intestinale (enterocita). A questo livello il ferro, ***in base alle quantità di apoferritina presenti***, può o rimanere confinato nell’enterocita oppure entrare in circolo. In caso di eccesso di ferro, il Fe2++ entrato nell’enterocita viene riossidato e si lega all’apoferritina, formando ferritina che si deposita nell’enterocita evitando l’ingresso in circolo di un eccesso di ferro che accumulandosi invece nei tessuti determinerebbe danno e morte cellulare (siderosi). La ferritina rimane quindi nell’enterocita fino a desquamazione, ed il ferro in eccesso alla ferritinasi si deposita come emosiderina (visibile al microscopio in forma di granuli; ferro amorfo legato in modo irreversibile a una forma di ferritina modificata). La ferritina è una proteina polimerica costituita da 24 subunità che formano una cavità centrale dove si possono depositare fino a 4500 atomi di ferro (ossido ferrico). In caso di deficienza di ferro la cellula intestinale sintetizza poca apoferritina e il ferro assorbito viene immesso nel plasma. Nel plasma viene riossidato a Fe3+++ dalla ferrossidasi I e II. Il ferro ossidato viene trasportato dalla transferrina ai tessuti dove viene rilasciato e distribuito a tutte le cellule che necessitano di ferro per la sintesi del gruppo eme (sintesi dei citocromi, della mioglobina e dell’emoglobina). La transferrina è una glicoproteina sintetizzata dal fegato. Il rilascio di ferro ha luogo a livello di specifici recettori di membrana. Si forma il complesso “transferrina-recettore” che entra nella cellula attraverso un processo di endocitosi clatrino-dipendente (*). Il ferro rimane nella cellula e si lega a una proteina carrier che lo trasporta ai mitocondri per la sintesi dell’eme oppure viene immagazzinato nella ferritina, mentre la transferrina ritorna nel plasma
(*) – La clatrina è una proteina fibrosa polimerizzata a forma di canestro che tappezza alcuni tipi di recettori permettendo l’endocitosi. Tale proteina avvolge, ricopre, ingloba il complesso recettore-sostanza e lo porta all’interno della cellula. All’interno si ha perdita di tale rivestimento per azione di un enzima depolarizzante, e il complesso si dissocia. I recettori tornano in superficie e la sostanza seguirà la sua strada metabolica.
Fisiopatologia molecolare del metabolismo del ferro
Meccanismi di rilascio dal macrofago
La maggior parte del ferro viene riutilizzata grazie al suo recupero derivante dal catabolismo dell’emoglobina: a fronte di 1-2 mg di ferro ricambiati giornalmente, ne vengono riutilizzati circa 20-30 mg rilasciati dal macrofago. Bisogna quindi ipotizzare che segnali analoghi a quelli destinati all’intestino devono pervenire al macrofago per regolarne il rilascio di ferro in base alle richieste dell’eritropoiesi. L’importanza del rilascio s’evidenzia in situazioni in cui ***per difetti genetici di proteine dell’esporto*** o per azione di citochine infiammatorie il rilascio di ferro al macrofago è bloccato.
Regolazioni sistemiche del ferro
Nel 2001 è stata identificata una proteina, denominata Epcidina o LEAP1 (Liver-expressed-antimicrobial peptide), prodotta dal fegato in condizioni di sovraccarico di ferro ed in grado di bloccare l’assorbimento di ferro e il rilascio dal macrofago (Ganz, 2003).
Lo studio di modelli animali e di patologie genetiche del metabolismo del ferro ha contribuito alla comprensione dei meccanismi molecolari relativi al trasporto, assorbimento e regolazione del ferro. L’identificazione di Epcidina, una proteina con la struttura di un peptide antimicrobico, prodotto dal fegato come principale regolatore del ferro sta cambiando radicalmente la nostra interpretazione del metabolismo del metallo. La produzione di Epcidina è attivata a seguito di stimoli infiammatori-infettivi o di eccesso di ferro e soppressa in condizioni di ipossia, anemia e carenza di ferro. La proteina denominata Epcidina regola sia l’assorbimento intestinale sia il rilascio dal macrofago.
Disordini del metabolismo del ferro
I disordini del metabolismo del ferro comportano deficit, sovraccarico o maldistribuzione del metallo e si possono classificare in patologie ereditarie e acquisite (Tabella I)
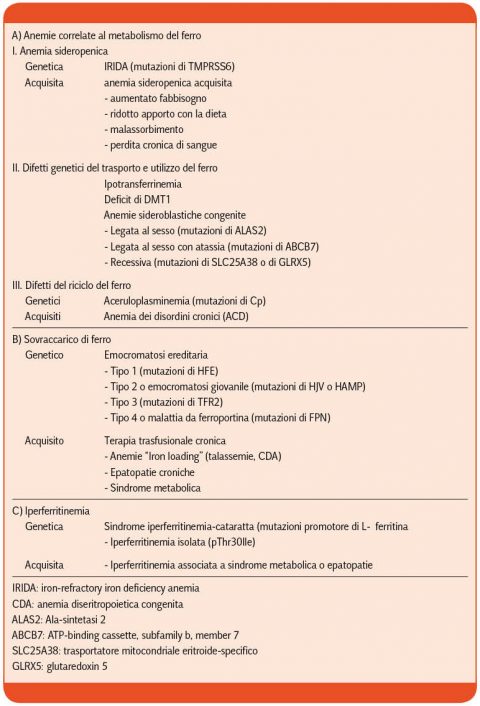
Approfondiremo i difetti genetici del trasporto ed utilizzo del ferro ed i difetti del riciclo del ferro.
Iron-refrectary iron deficiency anemia (IRIDA)
L’anemia da carenza di ferro, in inglese Iron-refrectary iron deficiency anemia, è una condizione caratterizzata di recente: trattasi di anemia ereditaria recessiva simile all’anemia sideropenica, ma caratterizzata da incapacità d’assorbire il ferro per eccessiva produzione dell’ormone regolatore epcidina. L’anemia non risponde al ferro orale e risponde solo parzialmente al ferro parenterale, che viene sequestrato nei macrofagi: di qui il nome “refrattaria”. E’ forse la più frequente anemia microcitica da alterazione genetica del metabolismo del ferro. Definita come entità nosologica solo nel 2008 (Finberg et al, 2008) PubMed sono pubblicati in letteratura i casi di 50 pazienti appartenenti a 32 famiglie di diversa origine geografica (De Falco et al, 2013) PubMed L’eccesso di epcidina, promuovendo la degradazione di ferroportina (Nemeth et al, 2004) PubMed, blocca il rilascio di ferro al plasma e dà luogo ad anemia ipocromico-microcitica con saturazione della transferrina estremamente ridotta e con ferritina normale/elevata I casi riportati in letteratura sono in genere di ? età pediatrica, ma, nonostante la sideropenia, ***mostrano crescita e sviluppo psico-fisico normali***.
Ipotransferrinemia
L’ipotransferrinemia è una condizione recessiva nota da tempo, caratterizzata da estrema riduzione della proteina di trasporto del ferro (transferrina) nella circolazione La patologia è estremamente rara e le segnalazioni in letteratura sono sporadiche. La riduzione del trasporto nella circolazione determina carenza di ferro grave a livello del midollo, mentre il ferro non legato alla transferrina (non-transferrin-bound-iron, NTBI) viene captato e si accumula nei parenchimi, soprattutto nel fegato, pancreas e cuore, per cui l’anemia si associa a sovraccarico di ferro.
Anemia da difetto di DMT1
Il deficit di divalent metal transporter 1 (DMT1) è una condizione autosomica recessiva causata da mutazioni inattivanti nel trasportatore di metalli divalenti, essenziale nel ciclo endosomico del recettore della transferrina (Andrews, 2008 PubMed; De Domenico et al, 2008 PubMed). Si tratta di una patologia estremamente rara. I casi descritti in letteratura appartengono a 4 famiglie. Il difetto di DMT1 si manifesta prevalentemente nella serie eritroide, mentre a livello duodenale la carenza di DMT1 è verosimilmente compensata dall’assorbimento di eme. I soggetti affetti presentano ridotto peso corporeo alla nascita e anemia microcita-ipocromica di varia gravità, che in alcuni casi ha richiesto supporto trasfusionale nelle prime settimane di vita (Iolascon and De Falco, 2009) PubMed. A differenza dell’anemia sideropenica i livelli di ferro, saturazione della transferrina e ferritina sono elevati, mentre il recettore solubile della transferrina (sTfR) è elevato (Tabella II), come nella sideropenia, segno di utilizzo insufficiente di ferro e di eritropoiesi ferro-carente. La dimostrazione del difetto molecolare richiede la determinazione della sequenza nucleotidica del gene DMT1. Sovraccarico di ferro epatico è presente in quasi tutti i pazienti noti. I valori di epcidina sono normali/ridotti.
Ossigeno e Funzione Mitocondriale
Il Mitocondrio, piccolissimo organulo cellulare comparso relativamente tardi nella filogenesi della vita sulla Terra, ha svolto un ruolo essenziale nella evoluzione della cellula ed ha sostanzialmente permesso, mettendo a disposizione una grande quantità di energia sotto forma di ATP, le forme di vita superiori. Il mitocondrio ha reso possibile l’utilizzazione, ai fini energetici, dell’Ossigeno con la conseguenza di una miglior degradazione dei metaboliti nutritivi. Fini meccanismi di controllo intramitocondriali, regolano, a seconda delle necessità metaboliche della cellula, l’attivazione delle specifiche vie biosintetiche o energetiche, che sono, nella glicolisi anaerobica molteplici, rispetto alla via metabolica unica della glicolisi anaerobica.
Un’eventuale disfunzione mitocondriale si ripercuote a tutti i livelli dell’organismo ed è spesso la fase iniziale della patologia: il mitocondrio infatti, non solo regola la produzione di energia e la riparazione strutturale, ma anche decide, in base ai segnali chimici che ne riceve, se la cellula deve autodistruggersi, tramite l’apoptosi.

Le malattie mitocondriali rappresentano un gruppo eterogeneo di sindromi cliniche accomunate da un deficit energetico del metabolismo mitocondriale. [Wallace, 1999].
Effects of Vitamin C on C.Diphtheria
Gli effetti della vitamina C sul batterio C.Diphtheria
La Vitamina C rende inattiva la tossina difterica ed aiuta a proteggere le cavie dall’esito fatale dell’intossicazione da difterite. E anche le cavie a cui sono state iniettate considerevoli quantità di questa sostanza diventano temporaneamente negative o decisamente meno sensibili a piccole dosi della tossina, come determinato dai test intercutanei. Gli esperimenti quindi indicano che la vitamina C svolge una parte importante nel meccanismo della naturale resistenza alla tossina della difterite.
Dopo il completamento di questo lavoro, si è venuti a sapere che simili risultati con Vitamina C e tossina della difterite sono stati presentati al meeting del 24 settembre 1934 alla French Academy of Sciences, da E. Harde.
Detoxication of diphtheria and tetanus toxins
Disintossicazione da tossine della difterite e tetano
The detoxication of diphtheria and tetanus toxins by the ascorbic acid appears to be an oxidation effect (Kligler & collab. 1938, Jungebluf 1941, Willison 1943, Petherick & Singer 1944)
La disintossicazione dalle tossine della difterite e del tetano da parte dell’acido ascorbico sembra essere un effetto di ossidazione (Kligler e collab. 1938, Jungebluf 1941, Willison 1943, Petherick & Singer 1944).
Inactivation of bacteriophage
L’inattivazione del batteriofago
The oxidation of cysteine splits hyaluronic acid (Skanse & Sundblad, 1943), while the oxidation of glutathione kills trypanosomes (Sfrangewuys 1937), and that glutathione + metal ions has a detoxicating effect on several bacterial toxins, among others diphtheria toxin (Petherick & Singer 1944). The inactivation of bacteriophage by cysteine and glutathione, as well as by ascorbic acid, which was found by Lominski (1936) may also have been due to the oxidation of these substances.
L’ossidazione della cisteina divide l’acido ialuronico (Skanse & Sundblad, 1943), mentre l’ossidazione del glutatione uccide i tripanosomi (Sfrangewuys 1937), ed il glutatione + ioni metallici ha un effetto disintossicante su più tossine batteriche, fra cui anche quella difterica (Petherick & Singer 1944). L’inattivazione del batteriofago da parte della cisteina e del glutatione, nonché da parte dell’acido ascorbico (trovato da Lominski 1936) può anche essere dovuta all’ossidazione di queste sostanze.
Accenni di storia del vaccino della difterite
Nel 1890 Behring riuscì a “svelenare” questo veleno, che lui per primo chiamò ”tossina” difterica, con Tricloruro di iodio, usandola come sostanza stimolante un’immunità specifica negli animali infettati (13). Tuttavia questa sostanza si rivelò facilmente deperibile e non adeguatamente sfuttabile come vaccino. Nel 1891-92 Roux, con Louis Martin e Auguste Chailloux, riuscì ad immunizzare animali contro il vibrione settico e contro la difterite con dosi sub-patogene di tossina. Dal siero di questi animali vaccinati ottennero poi il siero per la sieroprofilassi-terapia. La produzione di siero antidifterico a livello industriale per consentirne l’utilizzo a livello mondiale fu iniziata dal francese Roux, che produsse il siero antidifterico nell’Istituto Pasteur di Parigi immunizzando il cavallo e i suoi primi sieri furono usati nel 1894 facendo crollare le morti per difterite dal 60 al 24%. (13) Congresso medico di Londra del 1891 Per evitare il diffondersi dell’infezione si ebbe l’avvertenza di trattare anche i famigliari dei malati con dosi preventive di siero, nel tentativo di circoscrivere il focolaio d’infezione. A Torino, dopo l’adozione della sieroterapia la mortalità per difterite passò dal 67,6-41,9% del 1888-1894 al 22% del 1897, secondo una statistica fatta da Francesco Abba del laboratorio dell’Ufficio d’Igiene di Torino. Ma la riduzione della mortalità per difterite non fu da ascriversi solamente alla sieroprofilassi: infatti, ancor prima dell’introduzione della sieroterapia la mortalità per difterite in Europa era diminuita, specie in Inghilterra, per merito della diagnosi precoce, delle misure igieniche e di isolamento, dell’obbligo di denuncia e delle migliorate condizioni socio-sanitarie della popolazione in generale, come, del resto, si era verificato per tutte le altre malattie infettive, se si esclude il periodo attorno alla I Guerra Mondiale. Inoltre la sieroterapia e la sieroprofilassi non furono sufficienti a interrompere la catena di trasmissione della malattia, tantomeno ad eradicarla.
Ciò indusse valenti medici come l’italiano Angelo Celli (14) ad intervenire nel 1911 ***contro la proposta di rendere obbligatoria*** la sieroprofilassi antidifterica, sia per l’elevato costo sia per la dimostrata incapacità di questa a eradicare l’infezione.
Diphtheria with polyneuropathy in a closed community despite receiving recent booster vaccination
Polineuropatia difterica in una comunità chiusa nonostante recenti richiami
It is generally considered that a high rate of vaccination will protect a community against epidemic diphtheria. When diphtheria re-emerged in the late 1980s and early 1990s in Eastern Europe and Russia, including Latvia, cases of diphtheritic polyneuropathy (DP) occurred. Three major factors contributed to this Latvian diphtheria epidemic: declining childhood immunisation rates, declining immunity in previously vaccinated adults, and the importation of diphtheria from neighbouring countries. The maximum incidence of Diphtheria in Latvia was reached in 1995 with 369 cases and 27 deaths, a rate of 14.6 per 100 000. In 1995, the vaccination schedule was modified so that the second and third diphtheria booster doses were given at 7 and 14 rather than at 9 and 15 years of age. A mass vaccination campaign was initiated, targeted at providing at least 90% of adults between the ages of 25 and 60 with at least one booster dose of diphtheria toxoid vaccine
RESULTS
Patient characteristics
The 20 patients with diphtheritic polyneuropathy (DP) were 18–24 year old males with an average age of 19.7 years. Bacterial culture for Corynebacterium diphtheria (b.v. gravis) was positive in 10; it should be noted that antibiotic administration had been common prior to admission to hospital as prophylaxis, or on suspicion of diagnosis, during the 3 days over which this diphtheria outbreak developed. All 20 showed pharyngeal or tonsillar evidence of diphtheritic infection, two neck oedema, and 17 electrocardiographic myocarditis. Most (15 or 75%) were hospitalised in the Infectology Centre within the first 3 days of the localised infection. Five others were admitted from the 6th to 30th days. A total of 14 patients (70%) required treatment in specialised neurological departments.
Polineuropatia difterica in una comunità chiusa nonostante recenti richiami. Si ritiene in genere che un alto tasso di vaccinazione protegga una comunità contro un’epidemia di difterite. Quando la difterite riemerse alla fine del 1980 e all’inizio del 1990 in Europa orientale e in Russia, tra cui anche in Lettonia, si verificarono casi di polineuropatia difterica (DP). Tre fattori principali hanno contribuito a questa epidemia di difterite in Lettonia: abbassamento dei tassi d’immunizzazione infantile, perdita d’immunità negli adulti precedentemente vaccinati ed importazione di difterite dai paesi limitrofi. L’incidenza massima di difterite è stata raggiunta nel 1995 con 369 casi e 27 decessi, con un tasso di 14,6 per 100 000. Nel 1995 il programma vaccinale venne modificato in modo tale da somministrare la seconda e la terza dose di richiamo per la difterite a 7 e 14 anni piuttosto che a 9 e 15 anni. Venne avviata una campagna di vaccinazione di massa, mirata ad immunizzare almeno il 90% degli adulti di età compresa fra i 25 ed i 60 anni con almeno una dose di richiamo del vaccino contro la difterite.
RISULTATI
Le caratteristiche dei pazienti
I 20 pazienti con polineuropatia difterica (DP) erano in fascia d’età 18-24 anni, di sesso maschile e con un’età media di 19,7 anni. La coltura batterica per il Corynebacterium (b.v. gravis) è risultata positiva in 10 pazienti; va notato che per prassi comune sono stati somministrati antibiotici prima del ricovero in ospedale come profilassi o sospetto di diagnosi, esattamente nei 3 giorni durante i quali tale epidemia di difterite si è verificata. Tutti e 20 i pazienti hanno mostrato infezione difterica sia faringea che tonsillare, due pazienti hanno presentato edema al collo e 17 miocardite tramite elettrocardiogramma. La maggior parte (dal 15 al 75%) dei pazienti è stata ricoverata nel Centro d’Infettivologia entro i primi 3 giorni di infezione localizzata. Altri cinque sono stati ospedalizzati dal 6° al 30 ° giorno. Per un totale di 14 pazienti (70%) si è reso necessario il trattamento in reparti neurologici specialistici.
Natural Immunity to Diphtheria
Immunità naturale alla difterite
Eskimos are very susceptible to upper respiratory infections on contact with the outside world. Ordinary bacterial infections rarely occur. Diphtheria and scarlet fever are unknown clinically.
[…] immunity to the disease and the negative skin tests depend on the presence of antitoxin. This is interpreted as being due to a natural hereditary immunity dependent upon some non-specific antitoxic mechanism.
Il popolo eschimese è molto sensibile alle infezioni respiratorie superiori a contatto con il mondo esterno. Le infezioni batteriche ordinarie si verificano raramente. Difterite e scarlattina sono patologie clinicamente sconosciute.
[…] l’immunità alla malattia ed i test cutanei negativi dipendono dalla presenza di antitossine. Questo è interpretato come dovuto ad immunità ereditaria naturale dipendente da qualche meccanismo antitossico non specifico.
Riflessione personale a conclusione
L’agente patogeno della difterite, il batterio corynebacterium diphtheriae, esiste da tempo immemore, insieme ad altri batteri e virus che hanno avuto origine da prima dell’uomo!!!
Credo, e questa è ovviamente solo una tesi (e come tale sarà sicuramente fallace, questo è il motivo per cui studio cercando di aggiornarmi continuamente) che batteri e virus, come sono sempre esistiti da miliardi di anni, continueranno ad esistere, e come accennavo con altre persone privatamente, sono certa che ognuno di noi in adolescenza o in età adulta sia stat* affett* da una laringite/faringite/affezione simile un po’ più rognosa del solito e/o con placche ^_^.
Ebbene, sono convinta che quelli fossero episodi di difterite, dei 4 ceppi quello meno pericoloso! Questa sarebbe la dimostrazione che, come per il tetano vi siano dei booster naturali, altrettanto vi siano per la difterite (e probabilmente per qualsiasi altra patologia il cui agente patogeno sia virale o batterico) e questo giustificherebbe il fatto che nonostante la popolazione mondiale adulta sia da oltre 30 anni certamente priva d’immunità vaccinale contro la difterite, la patologia si verifichi solo in limitatissimi casi. Son altresì certa più che mai dell’influenza d’una corretta metabolizzazione mitocondriale del ferro come co-repressore della tossica difterica, così come dell’importanza della vitamina C, e questo ancor più spiegherebbe 3 decadi e più di sporadici casi di difterite!! Più che mai, gli studi scientifici rinvenuti confermano che un sistema immunitario sano, privo di disfunzioni metaboliche mitocondriali e nutrito in maniera sana e variegata, quindi priva di carenze di sorta, può incontrare il batterio senza sviluppare la patologia oppure senza avere una sua evoluzione nefasta Perché sarebbero i vaccinati i famigerati untori della difterite? Poiché il bacillo comunque entra nell’organismo, se in quello di una persona sana e non vaccinata si svilupperà la patologia ed i sintomi saranno visibili, e quindi (presumendo che la tal persona non sia un’incosciente) si cercherà d’evitare di contagiare altre persone!
Dato che questo batterio ha la capacità di sopravvivere sei mesi in un organismo vaccinato, quando avviene lo stesso meccanismo sopra descritto, il contagio avviene poiché il portatore sano NON sa di esserlo!!!
Buon approfondimento e buona riflessione.
Ricerche e traduzione a cura di Luana DiEmme
 quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere
quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere